
- •Одержання
- •Солі – це речовини, які при дисоціації утворюють йони основних і кислотних залишків.Солі поділяють на середні(нормальні), кислі та основні. Класифікація
- •Способи добування
- •Властивості
- •Середні солі
- •Кислі солі
- •Основні солі
- •Ковалентний неполярний зв'язок
- •Найважливіші окисники й відновники
- •Закон діючих мас в хімічній термодинаміці
- •Гомогенний каталіз
- •Гетерогенний каталіз
- •Залежність швидкості реакції від концентрації реагентів
- •Вплив температури на швидкість реакції
- •2. Температура кипіння і замерзання розчинів
- •32 Розчини електролітів. Електроліти - це речовини, які проводять електричний струм в розчиненому або розплавленому стані. Основні положення теорії електролітичної дисоціації
- •Зв'язок константи дисоціації і ступеня дисоціації
- •Класифікація
- •37 Реакції обміну між розчинами електролітів. Йонні рівняння
- •38 Гідроліз солей
- •Фізичні властивості
- •Хімічні властивості
Найважливіші окисники й відновники
Окисники |
Окисники й відновники |
Відновники |
Переважно містять елементи з найвищим ступенем окиснення |
Містять елементи із проміжними ступенями окиснення |
Містять елементи або йони з нижчими ступенями окиснення |
O2, O3, Mn2O7, KMnO4, K2Cr2O7, H2SeO4, HNO3, H2SO4(конц.), PbO2, KClO3, Fe3+, Ag+, HClO4 (безводна), галогени |
H2SO3, HNO2, H2O2, SO2, Na2O2, K2SO3, NaNO2 |
Метали, С, Н2, H2S, Р, СО, НІ, НBr, HCl, NH3, PH3, KI, NaBr, Fe2+, Sn2+, Mn2+, Cr3+ |
Внутрішня енергія складається з двох частин: 1) З вільної енергії, що може бути перетворена в роботу; 2) із зв’язаної енергії, яка не може бути перетворена в роботу.
Хімічні перетворення супроводжуються перебудовою електронних структур частинок реагуючих речовин (атомів, молекул, іонів тощо) і утворенням нових частинок з новими електронними структурами та властивостями. Відповідно швидкість хімічної реакції та механізм її перебігання залежать від міцності хімічного зв'язку в існуючих частинках. Чим легше руйнуються ці зв'язки, тим більшою буде швидкість реакції.
Хімічна взаємодія у випадку гомогенної реакції відбувається у всьому об'ємі реагуючої суміші; гетерогенна реакція відбувається лише на межі розподілу фаз. Перебіг гомогенних і гетерогенних реакцій у багатьох випадках різний. Тому говорять про кінетику гомогенних і гетерогенних реакцій.
Термохімічні рівняння реакцій - рівняння в яких вказано агрегатний стан реагуючих речовин і тепловий ефект
Наприклад:
2H2(г) + O2(г) = 2H2O(р) + Qp;
2H2(г) + O2(г) = 2H2O(р); DH.
Qp - тепловий ефект процесу при постійному тиску.
DH - ентальпія; DH = - Qp.
Ентальпія, також теплова функція і теплосодержание - термодинамічний потенціал, що характеризує стан системи в термодинамічній рівновазі при виборі в якості незалежних змінних тиску, ентропії і числа частинок.
Простіше кажучи, ентальпія - це та енергія, яка доступна для перетворення в теплоту за певних температурі і тиску.
Якщо термомеханічну систему розглядати як що складається з макротела ( газу) і поршня з вантажем вагою Р = p S, що врівноважує тиск газу р усередині судини, то така система називається розширеною.
Ентальпія або енергія розширеної системи Е дорівнює сумі внутрішньої енергії газу U і потенційної енергії поршня з вантажем E пот = pSx = pV
H = E = U + p V
Таким чином, ентальпія в даному стані являє собою суму внутрішньої енергії тіла і роботи, яку необхідно затратити, щоб тіло об'ємом V ввести в навколишнє середовище, що має тиск р і знаходиться з тілом в рівноважному стані. Ентальпія системи H - аналогічно внутрішньої енергії та іншим термодинамічним потенціалом - має цілком певне значення для кожного стану, тобто є функцією стану. Отже, в процесі зміни стану
Δ H = H 2 - H 1
Зміна ентальпії (або Тепловий ефект хімічної реакції) не залежить від шляху процесу, визначаючись тільки початковим і кінцевим станом Якщо система будь-яким шляхом повертається в початковий стан (круговий процес), то зміна будь-якого її параметра, що є функцією стану, дорівнює нулю, звідси Δ H = 0 , Або ж

![]()
Диференціал ентальпії, виражений у власних змінних - через ентропію S і тиск p:
Оскільки
в квазіравновесних
процесах ![]() -
Кількість теплоти, підведеної до системи,
звідси випливає фізичний зміст введення
поняття ентальпії: її зміна - це тепло,
підведене до системи в ізобаріческом
процесі (при
постійному тиску). Практичне застосування
цієї функції засноване на тому, що безліч
хімічних процесів в реальних або
лабораторних умовах реалізуються саме
при постійному (атмосферному) тиску,
коли резервуар відкритий. Так, ентальпія
освіти -
кількість енергії, яка виділяється або
поглинається при утворенні складного
речовини з простих речовин.
-
Кількість теплоти, підведеної до системи,
звідси випливає фізичний зміст введення
поняття ентальпії: її зміна - це тепло,
підведене до системи в ізобаріческом
процесі (при
постійному тиску). Практичне застосування
цієї функції засноване на тому, що безліч
хімічних процесів в реальних або
лабораторних умовах реалізуються саме
при постійному (атмосферному) тиску,
коли резервуар відкритий. Так, ентальпія
освіти -
кількість енергії, яка виділяється або
поглинається при утворенні складного
речовини з простих речовин.
Всі хімічні реакції супроводжуються виділенням (екзотермічні) або поглинанням (ендотермічні) тепла. Мірою теплоти реакції служить зміна ентальпії ΔН, яка відповідає теплообміну при постійному тиску. У разі екзотермічних реакцій система втрачає тепло і ΔН - величина негативна. У разі ендотермічних реакцій система поглинає тепло і ΔН - величина позитивна.
Ентальпією системи зручно користуватися в тих випадках, коли в якості незалежних змінних, що визначають стан системи, вибирають тиск р і температуру Т
H = H (p, T)
У цьому випадку зміна ентальпії в ізобаріческом процесі практично зручно розраховувати, знаючи теплоємність при постійному тиску C p (T)(Термохимический закон Кірхгофа):
При цьому використовується емпіричне розкладання теплоємності в ряд за ступенями Т:
![]()
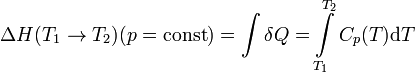
Ентальпія
- величина
адитивна (екстенсивна), тобто
для складної системи дорівнює сумі
ентальпій її незалежних частин ![]() .
Подібно до інших термодинамічних
потенціалів, ентальпія визначається з
точністю до постійного доданка, якому
в термодинаміці часто надають довільні
значення (наприклад, при розрахунку і
побудові теплових діаграм). При наявності
немеханічних сил величина ентальпії
системи дорівнює
.
Подібно до інших термодинамічних
потенціалів, ентальпія визначається з
точністю до постійного доданка, якому
в термодинаміці часто надають довільні
значення (наприклад, при розрахунку і
побудові теплових діаграм). При наявності
немеханічних сил величина ентальпії
системи дорівнює
![]()
де X i - Узагальнена сила; y i - узагальнена координата.
Гетерогенні системи - фізико-хімічні системи, що складаються з двох або кількох фаз, напр., система: «лід — вода — водяна пара» — гетероґенна система з трьох фаз.
Гомогенні системи - однорідна система, хімічний склад і фізичні властивості якої у всіх частинах однакові або змінюються безперервно, без стрибків (між частинами системи немає поверхонь розділу). У гомогенної системі з двох і більше хімічних компонентів кожен компонент розподілений в масі іншого у вигляді молекул, атомів, іонів. Складові частини гомогенної системи можна відокремити один від одного механічним шляхом.
В гомогенних сумішах складові частини можна знайти ні візуально, ні за допомогою оптичних приладів, оскільки речовини знаходяться в роздробленому стані на мікрорівні. Гомогенними сумішами є суміші будь-яких газів і істинні розчини, а також суміші деяких рідин і твердих речовин, наприклад сплави.
Інтенсивність проходження хімічних реакцій визначається швидкістю, тобто зміною концентрації реагента або продукту реакції за одиницю часу:
![]()
де С – молярна концентрація реагента, а t – час. Мінус перед правим членом обумовлений зниженням концентрації реагента в ході реакції. У виразі швидкості реакції за зміною концентрації продукту реакції мінус не ставиться. Отже, швидкість реакції завжди додатня.
Швидкість хімічної реакції залежить від:
температури: у разі підвищення температури на кожні 10 °С швидкість реакції зростає у два-чотири рази (правило Вант-Гоффа), Для початку хімічної реакції реагенти повинні мати певний запас енергії. Ця енергія Еа називається енергією активації, тобто це енергія, яку повинні матимолекули, що зіштовхуються, щоб зіткнення привело до хімічного перетворення.
природи реагентів,
концентрації реагентів (Закон діючих мас),
опромінення,
присутності каталізатора
