
- •Введение
- •I. Лабораторные работы Лабораторная работа № 1 Определение молекулярной массы углекислого газа
- •Лабораторная работа № 2 Скорость химических реакций. Смещение химического равновесия
- •Лабораторная работа № 3 Электролитическая диссоциация. Сильные и слабые электролиты
- •Лабораторная работа № 4 Определение кислотности (pH) водных растворов индикаторами. Гидролиз солей
- •Лабораторная работа № 5 Окислительно-восстановительные реакции
- •Лабораторная работа № 6 Комплексные соединения
- •Лабораторная работа № 7 Галогены
- •Лабораторная работа № 8 Сера. Сероводород. Кислородсодержащие соединения серы
- •Лабораторная работа № 9 Аммиак. Кислородные соединения азота
- •Лабораторная работа № 10 Магний. Щёлочно-земельные металлы. Алюминий
- •Лабораторная работа № 11 Медь. Цинк
- •Лабораторная работа № 12 Железо. Кобальт. Никель
- •II. Тестовые вопросы и задачи
- •2.1. Общая химия
- •2.2. Неорганическая химия
- •III. Тематический материал для подготовки к зачётному занятию
- •3.1. Основные понятия и законы химии
- •3.2. Строение атома
- •3.3. Периодический закон и периодическая система д.И. Менделеева
- •3.4. Химическая связь
- •3.5. Строение и свойства веществ
- •3.6. Химическая кинетика и химическое равновесие
- •3.7. Физико-химическая теория растворов
- •3.8. Окислительно-восстановительные процессы
- •3.9. Энергетика и термодинамика химических процессов
- •3.10. Комплексные соединения. Равновесия в водных растворах комплексных соединений
- •3.11. Классы неорганических соединений и их генетическая связь
- •3.12. Благородные газы
- •3.13. Водород. Вода. Геохимический цикл воды
- •3.1.4. Галогены
- •3.15. Халькогены. Кислород. Круговорот кислорода в природе
- •3.16. Сера
- •3.18. Фосфор
- •3.21. Общий обзор неметаллов
- •3.22. Алюминий
- •3.27. Олово. Свинец
- •3.28. Ванадий. Хром
- •3.29. Марганец. Железо
- •3.30. Кобальт. Никель
- •3.31. Формы нахождения металлов в природе. Металлургия
- •3.32. Общий обзор металлов
- •4. Ответы к тестовым вопросам и задачам
- •4.1. Общая химия
- •4.2. Неорганическая химия
- •5. Список рекомендуемой литературы Учебники
- •Сборники задач и практикумы
- •Практикум по химии для студентов I курса географического факультета
- •426034, Ижевск, ул. Университетская, 1, корп. 4
Лабораторная работа № 7 Галогены
Цель работы: изучить свойства и методы получения хлора, брома, йода и хлороводорода.
Приборы и реактивы: штатив с лапкой, колба Вюрца, капельная воронка с пробкой, мерный цилиндр, спиртовка, спички, лист белой бумаги, вата, стеклянная палочка, стеклянная пластинка, концентрированная соляная кислота (HCl), концентрированная серная кислота (Н2SO4), оксид марганца(IV) (MnO2), перманганат калия (KMnO4), хлорид натрия (NaCl), бромид калия (KBr), йодид калия (KJ), гексан, сероводородная вода, хлорная вода, бромная вода, растворы: лакмуса 0,1%-ный, метилового оранжевого 0,1%-ный, нитрата серебра (Ag(NO3)3) 0,5 н., бромида натрия (NaBr) 0,5 н., йодида калия (KJ) 0,5 н.
Опыт № 1. Получение хлора и хлорной воды
Соберите прибор, изображённый на рис. 7.1. В колбу Вюрца поместите 2-3 шпателя перманганата калия и добавляйте из капельной воронки по каплям концентрированную соляную кислоту. Наблюдайте выделение газа и отметьте его цвет, поместив за колбу лист белой бумаги. Со временем реакция в колбе замедляется, для ускорения выделения хлора необходимо нагреть содержимое колбы на спиртовке. Пропускайте хлор через холодную воду в течение 2-4 мин. Отметьте цвет полученной хлорной воды. Цилиндр закройте влажной фильтровальной бумагой. Полученную хлорную воду сохраните для последующих опытов.
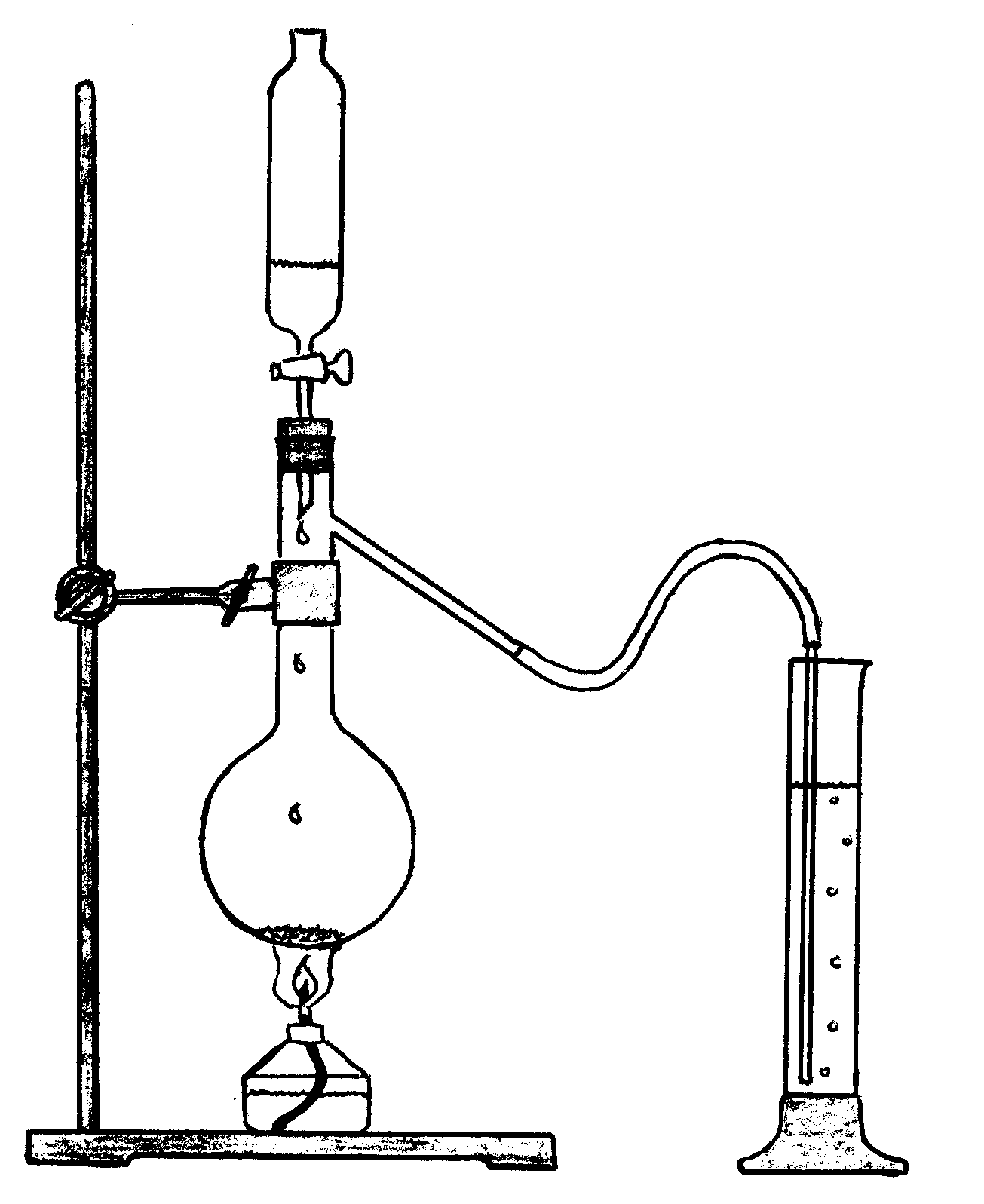
Рис. 7.1. Прибор для получения хлора и хлорной воды
Оформление опыта 1
1. Зарисуйте прибор для получения хлора и хлорной воды, подпишите его основные части.
2. Напишите уравнение реакции получения хлора, отметьте окислитель и восстановитель.
3. Какой цвет имеет газ хлор? Какова относительная плотность хлора по воздуху?
Опыт № 2. Свойства хлорной воды
Добавьте в 3 пробирки по 5 см3 хлорной воды, полученной в предыдущем опыте. В пробирку № 1 прилейте 1 см3 нейтрального раствора лакмуса. В пробирку № 2 добавьте несколько капель раствора нитрата серебра. В пробирку № 3 прилейте несколько капель сероводородной воды до появления мути. Запишите наблюдаемые признаки химических реакций.
Оформление опыта 2
1. Поясните, что такое хлорная вода. Какие равновесия наблюдаются в хлорной воде? Что происходит с хлорной водой при долгом хранении?
2. Напишите, как изменился цвет лакмуса (пробирка № 1) в хлорной воде в первоначальный момент времени. Объясните, почему лакмус в течение времени обесцвечивается в хлорной воде.
3. Какой осадок выпал в пробирке № 2. Отметьте цвет осадка. Напишите уравнение реакции.
4. Напишите реакцию хлорной воды с сероводородом. Расставьте коэффициенты методом электронно-ионного баланса.
Опыт № 3. Получение хлороводорода
Соберите прибор для получения хлороводорода (рис. 7.2). В колбу Вюрца поместите 3-4 шпателя хлорида натрия. Конец газоотводной трубки поместите в сухой сосуд для собирания хлороводорода
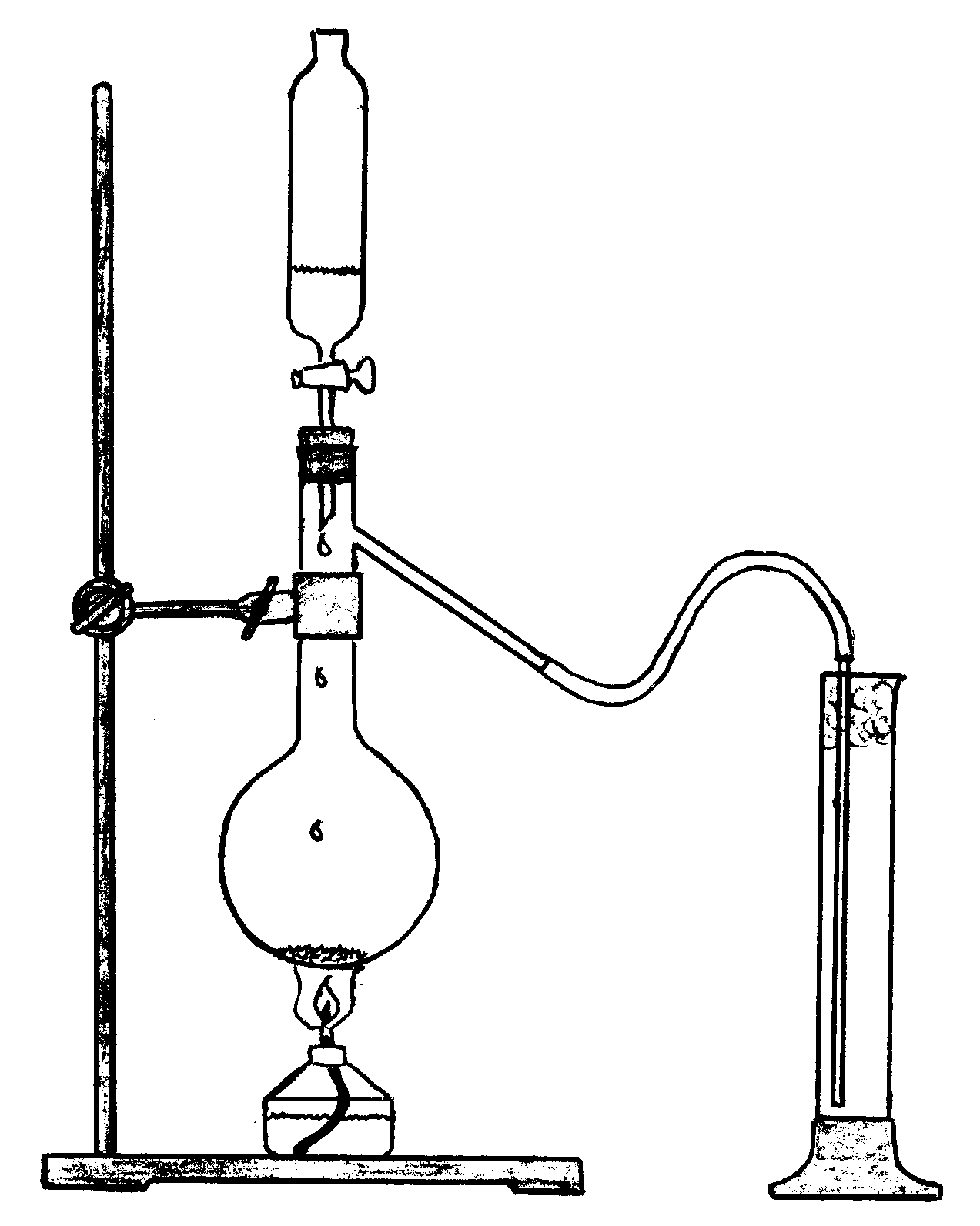
Рис. 7.2. Прибор для получения хлороводорода
так, чтобы трубка доходила почти до дна. Закройте отверстие сосуда рыхлым комочком ваты. Рядом с прибором поставьте кристаллизатор с водой, в который добавлено небольшое количество индикатора метилового оранжевого.
Из капельной воронки добавьте в колбу Вюрца небольшими порциями концентрированную серную кислоту. Наблюдайте за происходящими изменениями реагирующих веществ. Для ускорения реакции колбу слегка подогрейте на спиртовке. Когда над ватой, которой закрыто отверстие сосуда, появится туман (объясните причину его образования), нагревание колбы прекратите. Колбу с хлороводородом закройте стеклянной пластинкой. Перевернув колбу отверстием вниз, погрузите его в кристаллизатор с холодной водой и выньте пластинку. Наблюдайте поднятие уровня жидкости в колбе с хлороводородом. Отметьте изменение окраски индикатора метилового оранжевого.
Оформление опыта 3
1. Зарисуйте прибор для получения хлороводорода и подпишите его основные части.
2. Напишите уравнение реакции получения хлороводорода. Благодаря какому свойству серная кислота вытесняет хлороводородную из её солей?
3. Ответьте на следующие вопросы:
– какой цвет имеет газ хлороводород?
– почему хлороводород «дымит» на воздухе?
– чему равна относительная плотность хлороводорода по воздуху?
– какова растворимость хлороводорода в воде?
– как называется раствор хлороводорода в воде?
– о наличии какой среды свидетельствует окраска метилового оранжевого в водном растворе хлороводорода?
Опыт № 4. Получение брома и йода
В две пробирки внести по 2 микрошпателя оксида марганца(IV). В первую из них добавить 1 микрошпатель бромида калия, а в другую 1 микрошпатель йодида калия. В каждую пробирку внести по несколько капель концентрированной серной кислоты. Отметить выделение и цвет брома и йода в газообразном состоянии.
Оформление опыта 4
1. Написать уравнения протекающих реакций. Указать цвет газообразных брома и йода.
Опыт № 5. Сравнение окислительных свойств галогенов
В одну пробирку внесите 3-5 капель раствора бромида натрия, и в две другие – по 3-5 капель раствора йодида калия. Во все три пробирки добавить по 2-3 капли органического растворителя – гексана. В пробирки с раствором бромида и йодида внести по 3-4 капли хлорной воды, в последнюю пробирку с раствором йодида – столько же бромной воды. Содержимое пробирок встряхнуть и по окраске полученного слоя органического растворителя установить, какой галоген выделяется в свободном виде в каждой из пробирок.
Оформление опыта 5
1. Написать уравнения в молекулярной и ионной форме.
2. В каждом случае указать окислитель и восстановитель.
3. Расположить галогены в ряд по убыванию их окислительной активности. Объяснить последовательность расположения.
