
- •Введение
- •I. Лабораторные работы Лабораторная работа № 1 Определение молекулярной массы углекислого газа
- •Лабораторная работа № 2 Скорость химических реакций. Смещение химического равновесия
- •Лабораторная работа № 3 Электролитическая диссоциация. Сильные и слабые электролиты
- •Лабораторная работа № 4 Определение кислотности (pH) водных растворов индикаторами. Гидролиз солей
- •Лабораторная работа № 5 Окислительно-восстановительные реакции
- •Лабораторная работа № 6 Комплексные соединения
- •Лабораторная работа № 7 Галогены
- •Лабораторная работа № 8 Сера. Сероводород. Кислородсодержащие соединения серы
- •Лабораторная работа № 9 Аммиак. Кислородные соединения азота
- •Лабораторная работа № 10 Магний. Щёлочно-земельные металлы. Алюминий
- •Лабораторная работа № 11 Медь. Цинк
- •Лабораторная работа № 12 Железо. Кобальт. Никель
- •II. Тестовые вопросы и задачи
- •2.1. Общая химия
- •2.2. Неорганическая химия
- •III. Тематический материал для подготовки к зачётному занятию
- •3.1. Основные понятия и законы химии
- •3.2. Строение атома
- •3.3. Периодический закон и периодическая система д.И. Менделеева
- •3.4. Химическая связь
- •3.5. Строение и свойства веществ
- •3.6. Химическая кинетика и химическое равновесие
- •3.7. Физико-химическая теория растворов
- •3.8. Окислительно-восстановительные процессы
- •3.9. Энергетика и термодинамика химических процессов
- •3.10. Комплексные соединения. Равновесия в водных растворах комплексных соединений
- •3.11. Классы неорганических соединений и их генетическая связь
- •3.12. Благородные газы
- •3.13. Водород. Вода. Геохимический цикл воды
- •3.1.4. Галогены
- •3.15. Халькогены. Кислород. Круговорот кислорода в природе
- •3.16. Сера
- •3.18. Фосфор
- •3.21. Общий обзор неметаллов
- •3.22. Алюминий
- •3.27. Олово. Свинец
- •3.28. Ванадий. Хром
- •3.29. Марганец. Железо
- •3.30. Кобальт. Никель
- •3.31. Формы нахождения металлов в природе. Металлургия
- •3.32. Общий обзор металлов
- •4. Ответы к тестовым вопросам и задачам
- •4.1. Общая химия
- •4.2. Неорганическая химия
- •5. Список рекомендуемой литературы Учебники
- •Сборники задач и практикумы
- •Практикум по химии для студентов I курса географического факультета
- •426034, Ижевск, ул. Университетская, 1, корп. 4
Лабораторная работа № 3 Электролитическая диссоциация. Сильные и слабые электролиты
Цель работы: изучить способность к диссоциации различных веществ на основании данных об электропроводности; изучить влияние одноимённых ионов и разбавления на степень диссоциации веществ.
Приборы и реактивы: прибор для определения электропроводности растворов, стаканы 50 см3, дистиллированная вода, сахар (С12H22O11), хлорид натрия (NaCl), уксусная кислота (CH3COOH), ацетат натрия (CH3COONa), метиловый оранжевый, растворы: гидроксида натрия (NaOH) 0,1 н., серной кислоты (H2SO4) 0,1 н., сульфата меди (CuSO4) 0,1 н., гидроксида аммония (NH4OH) 0,1 н., уксусной кислоты (CH3COOH) 0,1 н., ацетата аммония (CH3COONH4) 0,1 н.
Опыт 1. Электропроводность веществ и их растворов
Соберите прибор для определения электропроводности растворов (рис. 3.1) и внимательно ознакомьтесь с инструкцией его работы.
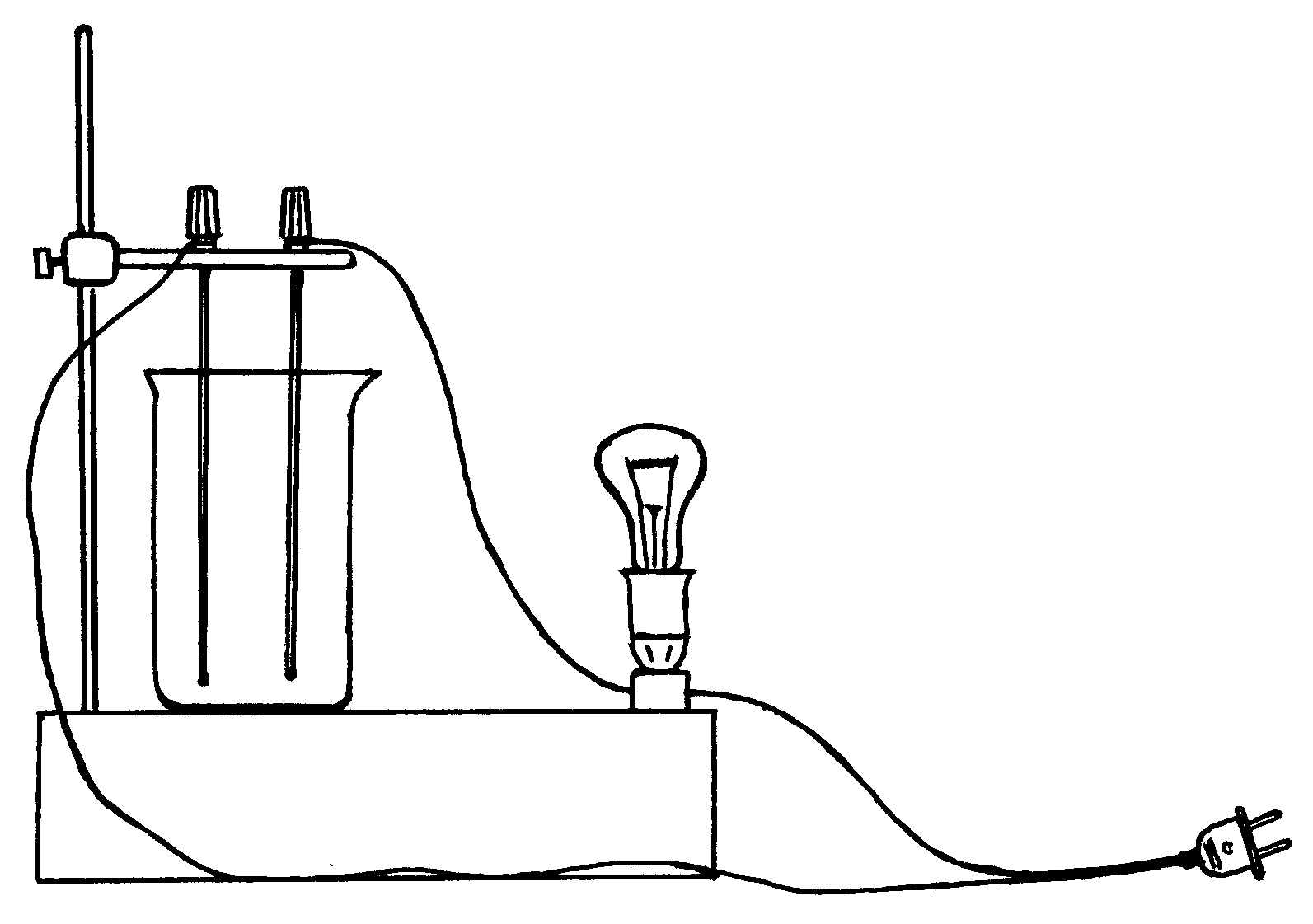
Рис. 3.1. Прибор для определения электропроводности растворов
Поместите вещества в стакан в последовательности указанной в таб. 3.1 и испытайте их электропроводность.
Оформление опыта 1
1. Оформите таб. 3.1. В столбце «интенсивность свечения лампы» сделайте соответствующие отметки: сильная, слабая, отсутствует. В столбце «сила электролита» укажите свойство: сильный, слабый, не электролит. Для электролитов напишите уравнение их диссоциации.
Таблица 3.1. Электропроводность веществ и растворов
Вещества |
Интенсивность свечения лампы |
Сила электролита |
Уравнение диссоциации |
Сахар |
|
|
|
NaCl |
|
|
|
Дистиллированная вода |
|
|
|
Раствор сахара |
|
|
|
Раствор NaCl |
|
|
|
Раствор NaOH |
|
|
|
Раствор H2SO4 |
|
|
|
Раствор CuSO4 |
|
|
|
Раствор NH4OH |
|
|
|
Раствор CH3COOH |
|
|
|
Раствор CH3COONH4 |
|
|
|
2. Объяснить, почему раствор хлорида натрия является проводником, а сухой хлорид натрия и дистиллированная вода, взятые в отдельности, тока не проводят.
3. Объяснить, почему сахар и раствор сахара не проводят электрический ток.
4. Объясните интенсивность свечения лампочки в растворах гидроксида аммония, уксусной кислоты и их соли.
5. Напишите выражение и численное значение констант диссоциации для слабых электролитов, использованных в данном опыте.
Опыт № 2. Влияние разбавления на степень электролитической диссоциации электролита
В стакан объёмом 100 см3 налейте 50 см3 концентрированной уксусной кислоты и опустите в нее электроды прибора для определения электропроводности растворов. По силе накала лампы отметьте, хорошо ли проводит ток концентрированная уксусная кислота?
Разбавьте уксусную кислоту в четыре раза дистиллированной водой (таб. 3.2). Измерьте электропроводность полученного раствора уксусной кислоты. Повторите разбавление раствора еще несколько раз и определите проводимость получаемых растворов.
Оформление опыта 2
1. Данные опыта занесите в таблицу 3.2. В столбцах «интенсивность свечения лампы» и «электропроводность раствора» сделайте необходимые отметки: сильная, слабая, отсутствует.
Степень разбавления уксусной кислоты |
Интенсивность свечения лампы |
Электропроводность раствора |
0 |
|
|
4 раза |
|
|
16 раз |
|
|
64 раза |
|
|
256 раз |
|
|
2. На основании полученных данных сделайте вывод о том, как зависит степень диссоциации электролита от разбавления раствора. В какую сторону сместилось равновесие диссоциации раствора уксусной кислоты?
3. Объясните, почему, начиная с некоторой величины разбавления электролита, электропроводность раствора падает?
Опыт № 3. Влияние одноимённых ионов на степень диссоциации слабого электролита
В две пробирки внесите по 5-7 капель раствора уксусной кислоты и по одной капле индикатора метилового оранжевого. Одну пробирку с уксусной кислотой оставьте в качестве контрольной, а в другую добавьте 1-2 микрошпателя сухой соли ацетата натрия. Встряхните раствор и сравните цвет полученного раствора с цветом раствора в контрольной пробирке.
Оформление опыта 3
1. Напишите уравнение диссоциации уксусной кислоты.
2. Какой цвет имеет индикатор метиловый оранжевый в различных средах.
3. Объясните, как смещается равновесие диссоциации уксусной кислоты при добавлении к ней ацетат-ионов, на основании изменения окраски индикатора.
4. Увеличится или уменьшится степень диссоциации уксусной кислоты при добавлении к ней сильной кислоты?
