
- •Введение
- •I. Лабораторные работы Лабораторная работа № 1 Определение молекулярной массы углекислого газа
- •Лабораторная работа № 2 Скорость химических реакций. Смещение химического равновесия
- •Лабораторная работа № 3 Электролитическая диссоциация. Сильные и слабые электролиты
- •Лабораторная работа № 4 Определение кислотности (pH) водных растворов индикаторами. Гидролиз солей
- •Лабораторная работа № 5 Окислительно-восстановительные реакции
- •Лабораторная работа № 6 Комплексные соединения
- •Лабораторная работа № 7 Галогены
- •Лабораторная работа № 8 Сера. Сероводород. Кислородсодержащие соединения серы
- •Лабораторная работа № 9 Аммиак. Кислородные соединения азота
- •Лабораторная работа № 10 Магний. Щёлочно-земельные металлы. Алюминий
- •Лабораторная работа № 11 Медь. Цинк
- •Лабораторная работа № 12 Железо. Кобальт. Никель
- •II. Тестовые вопросы и задачи
- •2.1. Общая химия
- •2.2. Неорганическая химия
- •III. Тематический материал для подготовки к зачётному занятию
- •3.1. Основные понятия и законы химии
- •3.2. Строение атома
- •3.3. Периодический закон и периодическая система д.И. Менделеева
- •3.4. Химическая связь
- •3.5. Строение и свойства веществ
- •3.6. Химическая кинетика и химическое равновесие
- •3.7. Физико-химическая теория растворов
- •3.8. Окислительно-восстановительные процессы
- •3.9. Энергетика и термодинамика химических процессов
- •3.10. Комплексные соединения. Равновесия в водных растворах комплексных соединений
- •3.11. Классы неорганических соединений и их генетическая связь
- •3.12. Благородные газы
- •3.13. Водород. Вода. Геохимический цикл воды
- •3.1.4. Галогены
- •3.15. Халькогены. Кислород. Круговорот кислорода в природе
- •3.16. Сера
- •3.18. Фосфор
- •3.21. Общий обзор неметаллов
- •3.22. Алюминий
- •3.27. Олово. Свинец
- •3.28. Ванадий. Хром
- •3.29. Марганец. Железо
- •3.30. Кобальт. Никель
- •3.31. Формы нахождения металлов в природе. Металлургия
- •3.32. Общий обзор металлов
- •4. Ответы к тестовым вопросам и задачам
- •4.1. Общая химия
- •4.2. Неорганическая химия
- •5. Список рекомендуемой литературы Учебники
- •Сборники задач и практикумы
- •Практикум по химии для студентов I курса географического факультета
- •426034, Ижевск, ул. Университетская, 1, корп. 4
Федеральное агентство по образованию
ГОУ ВПО «Удмуртский государственный университет»
Кафедра неорганической и аналитической химии

Практикум по химии
для студентов I курса
географического факультета
Ижевск
2007
УДК 546(075)
ББК 24.1.я7
П691
Составитель: Д.А. Меркулов, к.х.н.,
под редакцией профессора, д.х.н. В.И. Корнева
Практикум по химии для студентов I курса географического факультета/ Ижевск: Изд-во Удмурт. ГУ. 2007. 73 с.
Настоящее учебное пособие по химии содержит методические указания к выполнению лабораторных работ, тестовые вопросы и задания для самопроверки знаний с ответами, содержание тем лекционных занятий для подготовки к итоговому зачёту, а так же список рекомендуемой литературы.
Практикум предназначен для студентов I курса географического факультета УдГУ обучающихся по специальностям 012500 «география» и 013400 «природопользование».
УДК 546 (075)
Д.А. Меркулов, сост., 2007
Удмуртский госуниверситет, 2007
Введение
Предлагаемое учебно-методическое пособие по химии составлено для студентов географического факультета УдГУ, обучающихся по специальностям «география» и «природопользование». Целью данного пособия является оказание помощи студентам при выполнении и оформлении лабораторных работ, а так же при самоподготовке к контрольным работам и итоговому зачёту по предмету.
Практикум содержит методические указания к 12 лабораторным работам по курсу общей и неорганической химии. Порядок и содержание лабораторных работ соответствуют календарному плану лекционных занятий. Выполнение практических занятий способствует систематизации, закреплению и расширению теоретических знаний.
При подготовке к практическому занятию студент обязан повторить теоретический материал работы, используя учебную литературу и записи в лекционных тетрадях. К моменту выполнения лабораторной работы студент должен знать содержание работы и предполагать результаты выполнения опытов. Необходимые экспериментальные данные, выводы и ответы на вопросы оформляются в лабораторной тетради и сдаются преподавателю на проверку.
Для самостоятельной подготовки по предмету в учебно-методическом пособии приводится список рекомендованной литературы (учебники, сборники задач и практикумы). Студенту первокурснику иногда очень сложно отделить главное от второстепенного из всего того многообразия материала, содержащегося в литературных источниках. В то же время лекционные записи, в силу различных обстоятельств, могут быть не полны или частично искажены. В виду изложенного, в пособие включён тематический материал для подготовки к зачётному занятию, который полностью дублирует программу лекционных занятий.
Во время отработки знаний по химии студенту желательно придерживаться порядка изложения лекционного материала. Повторяя теоретические вопросы, необходимо продумать план ответа. При этом полезно посмотреть на свой план критически, проверить, будет ли ответ по такому плану исчерпывающим и в то же время кратким, нельзя ли как-то его улучшить. Такая целенаправленная работа над каждым вопросом, несомненно, повысит эффективность подготовки.
Итогом повторения и систематизации знаний является выполнение, предложенных в данной работе, тестовых заданий. Уровень самоподготовки несложно оценить, подсчитав количество правильных ответов.
I. Лабораторные работы Лабораторная работа № 1 Определение молекулярной массы углекислого газа
Цель работы: применить знания о газовых законах для практического определения молекулярной массы углекислого газа.
Приборы и реактивы: прибор для определения молекулярной массы углекислого газа, весы технические, барометр, термометр, углекислотный баллон с редуктором, аспиратор, ареометр, мерный цилиндр на 1000 см3.
Выполнение работы. Измерить и записать температуру (Т) и атмосферное давление (p) в лаборатории во время эксперимента.
Сухую пластиковую бутыль объёмом 5 дм3 закрыть пробкой с двумя газоотводными трубками (рис. 1.1) и взвесить на технических весах с точностью до 0,02 г. Значение массы бутыли с воздухом (m(т+возд.)) записать в лабораторную тетрадь. Чтобы во время работы не нагревать бутыль руками, необходимо держать и переносить бутыль пальцами за горло.
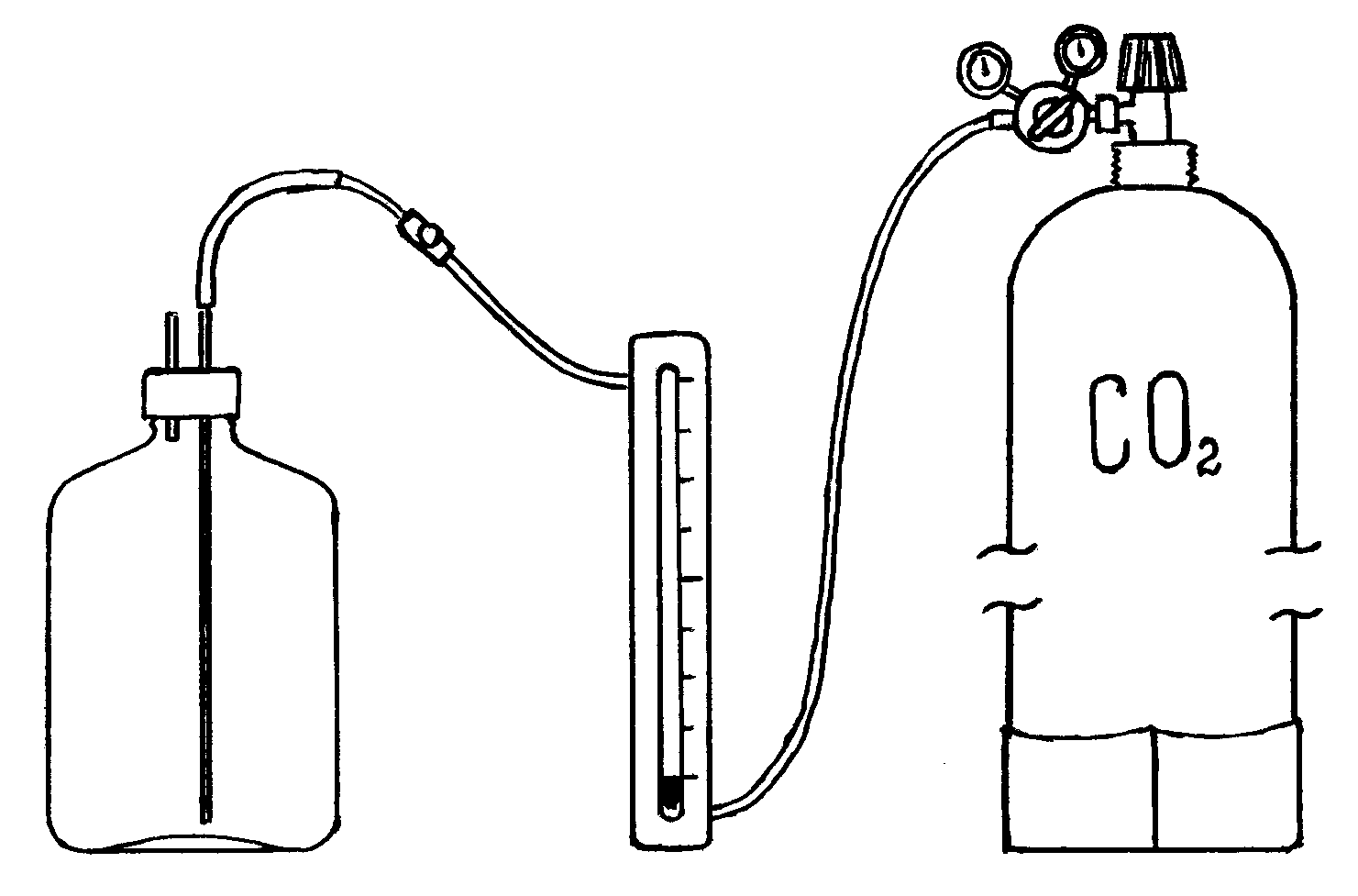
Рис. 1.1. Прибор для определения молекулярной массы углекислого газа
Заполнить бутыль углекислым газом. Для этого длинную газоотводную трубку бутыли соединить с газовым углекислотным баллоном через редуктор и аспиратор. Пропустить через бутыль 30-35 дм3 углекислого газа, отсоединить бутыль по месту разъёма и соединить газоотводные трубки бутыли между собой. Взвесить колбу с углекислым газом на тех же весах и с той же точностью, что и колбу с воздухом. Данные записать. Произвести контрольный опыт. В ту же колбу дополнительно пропустить углекислый газ в объёме 10-15 дм3 и снова взвесить колбу. Если воздух из колбы был вытеснен полностью углекислым газом, то результаты первого и второго взвешивания не должны расходиться более чем на 0,02 г. Полученные данные (m(т+СO2)) занести в тетрадь.
Измерить объём газа в бутыли (V), для чего наполнить бутыль с газоотводными трубками дистиллированной водой и взвесить её. Зная массу (m(H2O)) и плотность дистиллированной воды ((H2O)), измеренную ареометром, можно вычислить объём бутыли (V).
Формулу для определения молекулярной массы углекислого газа можно вычислить из пропорции:
М(CO2) – Mcp(возд.) – Vm (1.1)
m(т+СO2) – m(т+возд.) – V0,
где V0 – объём газа в бутыли, находящийся при нормальных условиях (T = 273 K, p = 101 325 Па), Vm – мольный объём газа, дм3/моль
Преобразуя пропорцию (1.1) получим
М(CO2) – Mcp(возд.) = (m(т+СO2) – m(т+возд.)) Vm / V0 (1.2)
Учитывая, что
V0 = p V T0 / (T p0)
в условиях эксперимента выражение (1.2) примет вид
М(CO2) = [(m(т+СO2) – m(т+возд.)) Vm T p0 / V T0 p] + Mcp(возд.)
Mr(CO2) = [M(CO2)]
Оформление работы
1. Зарисовать прибор для определения молекулярной массы углекислого газа. Подписать его основные части.
2. Записать значения следующих величин:
– температура воздуха (T), К
– давление (р), Па
– масса бутыли с воздухом (m (тара+возд.)), г
– масса бутыли с углекислым газом (m (тара+СO2)), г
– масса бутыли с углекислым газом (контроль) (m (тара+СO2)), г
– масса воды в бутыли (m(H2O)), г
– плотность воды ((H2O)), г
– объём газа в бутыли в условиях эксперимента (V), дм3
3. Рассчитать молекулярную массу углекислого газа по выведенной формуле
