
- •17. Электрический заряд, его свойства. Закон Кулона. Электрическое поле, напряженность электрического поля, принцип суперпозиции. Напряженность поля точечного заряда и системы зарядов.
- •23. Энергия взаимодействия электрических зарядов. Энергия и плотность энергии электрического поля.
- •24. Конденсаторы. Емкость и энергия конденсатора. Емкость плоского, цилиндрического и сферического конденсаторов. Последовательное и параллельное соединение конденсаторов.
- •25. Поляризация диэлектриков, типы поляризации. Вектор поляризации. Объемные и поверхностные поляризационные заряды, их связь с вектором поляризации.
- •2. Законы идеальных газов: Бойля-Мариотта, Гей-Люссака, Авогадро, Дальтона..
- •3. Внутренняя энергия идеального газа. Степени свободы. Теорема о равномерном распределении кинетической энергии по степеням свободы.
- •4. Основное уравнение молекулярно-кинетической теории. Средняя кинетическая энергия молекул, молекулярно-кинетический смысл температуры.
- •5 .Функция распределения молекул по скоростям. Распределение Максвелла.
- •6.Идеальный газ в поле силы тяжести. Барометрическая формула.Распределение Больцмана.
- •8.Явления переноса. Вязкость, теплопроводность и диффузия газов.
- •9.Макроскопическая работа, количество тепла. Первое начало термодинамики.
- •10.Первое начало термодинамики. Применение его для различных процессов.
- •11.Теплоемкость. Теплоемкость идеальных газов. Уравнение Майера.
- •12.Изопроцессы, изопроцессы идеального газа.
- •13Адиабатический процесс. Уравнение Пуассона.
2. Законы идеальных газов: Бойля-Мариотта, Гей-Люссака, Авогадро, Дальтона..
Закон Бойля-Мариотта: При постоянной температуре и массе идеального газа произведение его давления и объёма постоянно. Формула: pV = const (Изотермический процесс)
Закон Гей-Люссака:при постоянном давлении объём постоянной массы газа пропорционален абсолютной температуре. Формула: V/T=const (Изобарный процесс)
З![]() акон
Авогадро: 1
Киломоль любого газа занимает при
одинаковых условиях одинаковый объём.
При норм.условиях (t=0,
Р=10^5 Па) V
=22.4 м^3. Закон
Дальтона:
Давление смеси газов равно сумме
парциальных давлений.
акон
Авогадро: 1
Киломоль любого газа занимает при
одинаковых условиях одинаковый объём.
При норм.условиях (t=0,
Р=10^5 Па) V
=22.4 м^3. Закон
Дальтона:
Давление смеси газов равно сумме
парциальных давлений.
Закон Шарля : (Изохорный процесс V=const ). P/V=const. , Т- абсолютная температура (t+273)
3. Внутренняя энергия идеального газа. Степени свободы. Теорема о равномерном распределении кинетической энергии по степеням свободы.
В
теории идеального газа потенциальная
энергия взаимодействия молекул считается
равной нулю. Поэтому внутренняя энергия
идеального газа определяется кинетической
энергией движения всех его молекул.
Формула:
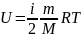 Степени
свободы- это
число независимых координат, которые
необходимо задать для определения
положения тела в пространстве. Одноатомный
– i=3;2-х
- i=5;
3-х - i=6
; Теорема
о равномерном распределении кинетической
энергии по степеням свободы-
В состоянии термодинамического равновесия
на каждую степень свободы движения
частиц вещества приходится кинетическая
энергия в среднем, равная kT/2.
(многоатомная
молекула Ек=i/2KT).
Степени
свободы- это
число независимых координат, которые
необходимо задать для определения
положения тела в пространстве. Одноатомный
– i=3;2-х
- i=5;
3-х - i=6
; Теорема
о равномерном распределении кинетической
энергии по степеням свободы-
В состоянии термодинамического равновесия
на каждую степень свободы движения
частиц вещества приходится кинетическая
энергия в среднем, равная kT/2.
(многоатомная
молекула Ек=i/2KT).
4. Основное уравнение молекулярно-кинетической теории. Средняя кинетическая энергия молекул, молекулярно-кинетический смысл температуры.
Основное
уравнение МКТ связывает макроскопические
параметры газовой системы с
микроскопическими.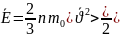 ,где Е-Ек
,n-концентрация
молекул
,где Е-Ек
,n-концентрация
молекул
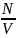 , k
= 1.38*10^-13 Дж/К –постоянная Больцмана.
, k
= 1.38*10^-13 Дж/К –постоянная Больцмана.
Средняя
кинетическая энергия поступательно
движения молекул:
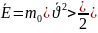
Температура
определяется
через микроскопические характеристики
системы и служит мерой энергии
неупорядоченного движения частиц.
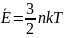
5 .Функция распределения молекул по скоростям. Распределение Максвелла.
,где m0 – масса одной молекулы, exp(e) – основание натуральных логарифмов (е = 2,72). К- постоянная Больцмана.
У всех молекул разные скорости. При столкновении эти скорости изменяются. Распределение Максвелла - распределение вероятности, встречающееся в физике и химии. Оно лежит в основании кинетической теории газов, которая объясняет многие фундаментальные свойства газов, включая давление и диффузию.
6.Идеальный газ в поле силы тяжести. Барометрическая формула.Распределение Больцмана.
В
идеальном газе, находящемся во внешнем
поле сил,
каждая отдельная частица приобретает
импульс в направлении силы, а также
соответствующую потенциальную энергию.
Однако в газе наряду с упорядоченным
движением в направлении действия силы
существует хаотическое тепловое
движение. В результате конкуренции
между этими двумя типами движений
возникает неравномерное распределение
макроскопических параметров: плотности
частиц, давления, температуры по объему,
занимаемому газом.Барометрическая
формула —
зависимость давления или плотности
газа от высоты в поле тяжести.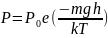 . применима
для разреженных смесей газов.
В присутствии гравитационного поля
(или, в общем случае, любого потенциального
поля) на молекулы газа действует сила
тяжести. В результате, концентрация
молекул газа оказывается зависящей от
высоты в соответствии с законом
распределения Больцмана:
. применима
для разреженных смесей газов.
В присутствии гравитационного поля
(или, в общем случае, любого потенциального
поля) на молекулы газа действует сила
тяжести. В результате, концентрация
молекул газа оказывается зависящей от
высоты в соответствии с законом
распределения Больцмана:
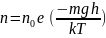 , где е- основание натуральных логарифмов.
(2.72).
, где е- основание натуральных логарифмов.
(2.72).
