
- •I и II законы термодинамики. Расчет тепловых эффектов химических реакций.
- •Гальванический элемент. Расчет эдс гальванического элемента.
- •Диссоциация комплексных соединений. Константы устойчивости комплексных ионов.
- •Донорно-акцепторная связь. Комплексные соединения.
- •Закон Гесса и следствия из него.
- •Закон эквивалентов
- •Интерметаллические соединения и твёрдые растворы Ме.
- •Ионное произведение воды. Водородный показатель среды.
- •Коллигативные свойства растворов.
- •Комплексные соединения. Хим. Связь в комплексных Соединениях.
- •Овр. Определение, классификация.
- •Основные понятия химии
- •Открытие Периодического закона д.И. Менделеевым
- •Структура периодической системы элементов
- •Понятие о стандартном состоянии и стандартных теплотах образования. Вычисление тепловых эффектов химических реакций.
- •Понятие об электродном потенциале.
- •Свободная энергия Гиббса. Направление химической реакции.
- •Свойства d –элементов. Сплавы и химические соединения. Физико-химические свойства металлов. Основные способы получения.
- •Соли и их хим. Свойства.
- •Степень и константа электролитической диссоциации. Закон разведения Оствальда.
- •Химическая коррозия. Скорость химической коррозии.
- •Электродный потенциал. Уравнение Нернста.
- •Электролиз с нерастворимым и растворимым анодами. Электролиз. Выходу по току.
- •Электролиз. Законы Фарадея.
- •Электрохимическая коррозия. Её скорость.
I и II законы термодинамики. Расчет тепловых эффектов химических реакций.
Формулировка I закона т/д: энергия не создается и не уничтожается, а лишь переходит из одной формы в другую в эквивалентном соотношении.
Формулировка II закона т/д: в изолированной системе самопроизвольно протекают те процессы, которые сопровождаются возрастанием энтропии.
Общий закон термодинамики: в любой изолированной системе полная энергия остается постоянной, а энтропия возрастает.
Тепловой эффект химической реакции – изменение энергии системы при протекании в ней химической реакции при условии, что система не совершает никакой другой работы, кроме работы расширения.
Термохимия – раздел химии, изучающий тепловые эффекты химических реакций.
Термохимическое уравнение – уравнение химической реакции, учитывающее фазовое состояние всех веществ системы и тепловой эффект химической реакции (ΔH).
Энтальпия (теплота) образования – тепловой эффект образования 1 моль сложного вещества из простых веществ, устойчивых при 298 К и давлении 100 кПа. ΔHобр. [кДж/моль]
Теплота разложения – количество теплоты, выделяющееся или поглощающееся при разложении 1 моль сложного вещества на простые. ΔHраз
Теплота сгорания – количество теплоты, которое выделяется при полном сгорании 1 моль вещества. ΔHсг
Расчет тепловых эффектов химических реакций: тепловой эффект химической реакции равен сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов.
bB + dD = lL + mM ΔH=l ΔHL + m ΔHM - d ΔHD – bΔHB
Энтропия – мера беспорядка в системе. S=Q/T S=[Дж/моль*К]
Активность и ионная сила растворов. Связь между коэффициентом активности и ионной силой раствора.
Активность компонентов раствора — эффективная (кажущаяся) концентрация компонентов с учётом различных взаимодействий между ними в растворе. a=f*c
Ионная
сила раствора —
мера интенсивности электрического
поля,
создаваемого ионами в
растворе. μ= ∑Ci*Zi2
∑Ci*Zi2
При
μ≤0,01
f
рассчитывают по уравнению Дебая-Хюккеля:
lgf=-0,509Z2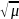
При высоких ионных силах f рассчитывается по формуле Дэвиса:
lgf=Z2[0,2
μ
-
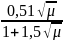 ]
]
Водородная связь.
Химическая связь, образованная положительно поляризованным водородом молекулы А – Н и электроотрицательным атомом В или той же молекулы, называется водородной связью. Если в.с. образуется между разными молекулами, она называется межмолекулярной. Если связь образуется между двумя группами одной и той же молекулы, то она называется внутримолекулярной.
Газовые электроды. Уравнение Нернста для расчета потенциалов газовых электродов.
Газовые
электроды
состоят из проводника 1-го рода,
контактирующего одновременно с газом
и раствором, содержащим ионы этого
газа. Проводник 1-го рода служит для
подвода и отвода электронов и, кроме
того, является катализатором электродной
реакции (ускоряет установление равновесия
на электроде). Проводник 1-го рода не
должен посылать в раствор собственные
ионы. Лучше всего удовлетворяют этому
условию платина и платиновые металлы,
поэтому они чаще всего используются
при создании газовых электродов. Так
как в равновесных электродных реакциях
газовых электродов участвуют газообразные
компоненты, то электродные потенциалы
этих электродов зависят от парциальных
давлений газов. Это можно показать на
примерах водородного и кислородного
электродов. Равновесие на водородном
электроде выражается уравнением
2Н++3е↔Н2.
Уравнение для расчетов потенциалов
водородного электрода можно вывести
так же, как было введено уравнение для
расчета потенциала металлического
электрода. Оно имеет вид:
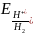 =
=
 или для 298 К
или для 298 К
 lg
lg
