
- •Введение
- •1. Физико-химические основы процесса синтеза метанола
- •2. Описание расчетной схемы цикла синтеза метанола
- •3. Методика расчета цикла синтеза метанола
- •4. Реактор синтеза метанола и технологическая схема
- •5. Исходные данные программы
- •6. Результаты расчета
- •7. Инструкция по работе с программой
- •7.1. Начальный и завершающий этапы работы с системой
- •7.2. Ввод и корректировка исходных данных
- •7.3. Выполнение расчета
- •7.4 Просмотр и печать результатов расчета
- •Исходные данные
- •Результаты расчета
- •Результаты расчета
- •Литература
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ РОССИЙСКОЙ ФЕДЕРАЦИИ
РОССИЙСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ НЕФТИ И ГАЗА
им. И.М.ГУБКИНА
СОСНА М.Х., ГРИГОРЬЕВА Н.А.
Методические указания по выполнению лабораторных работ
Расчёт процесса синтеза метанола по циркуляционной схеме в реакторах адиабатического и изотермического типа
Под редакцией профессора Лапидуса А.Л.
МОСКВА - 2006
УДК 622.276.53
Сосна М.Х., Григорьева Н.А.: Методические указания: Расчёт процесса синтеза метанола по циркуляционной схеме в реакторах адиабатического и изотермического типа
/ Под ред. А.Л. Лапидуса. – М.: РГУ нефти и газа, 2006. - 22 с.
В методических указаниях по выполнению лабораторной работы «Расчёт процесса синтеза метанола по циркуляционной схеме в реакторах адиабатического и изотермического типа» дана методика проведения лабораторных работ по курсу «Технология производства синтез-газа»: изложены краткие теоретические сведения по процессу получения метанола, технологическая схема процесса, приведены принципы расчета реактора синтеза метанола, инструкция по работе с программой по расчету процесса синтеза метанола.
Методические указания предназначены для студентов РГУ нефти и газа им. И.М. Губкина направления 655000 «Химическая технология органических веществ и топлива» (дипломированные специалисты), специальность 2504 «Химическая технология природных энергоносителей и углеродных материалов», направления 550800 «Химическая технология и биотехнология (бакалавры), программа 550801 «Химия и технология продуктов основного органического и нефтехимического синтеза» и 550809 «Химическая технология топлив и газа» (магистры).
Издание подготовлено на кафедре «ГАЗОХИМИИ».
Методические указания одобрены к изданию учебно-методической комиссией факультета химической технологии и экологии.
Рецензент
д.т.н., проф.
Лыков О.П.
Российский государственный университет нефти и газа им. И.М. Губкина, 2006
Содержание
|
стр. |
Введение |
4 |
1. Физико-химические основы процесса синтеза метанола……… |
5 |
2. Описание расчетной схемы цикла синтеза метанола………….. |
8 |
3. Методика расчета цикла синтеза метанола…………………..…. |
10 |
4. Реактор синтеза метанола и технологическая схема……..…….. |
11 |
5. Исходные данные программы…………………………………….. |
13 |
6. Результаты расчета…………………………………………………. |
14 |
7. Инструкция по работе с программой |
15 |
7.1. Начальный и завершающий этапы работы с системой……... |
15 |
7.2. Ввод и корректировка исходных данных……………………… |
16 |
7.3. Выполнение расчета……………………………………………… |
17 |
7.4. Просмотр и печать результатов расчета……………………… |
18 |
Приложения…………………………………………………………..... |
19 |
Литература……………………………………………………………… |
26 |
Введение
Метанол (метиловый спирт) - один из важнейших по значению и масштабам производства из продуктов, вырабатываемых химической промышленностью.
Известно несколько способов получения метанола:
синтез из СО и Н2;
сухая переработка древесины и лигнина;
термическое разложение солей муравьиной кислоты;
синтез из метана через метилхлорид с последующим омылением;
неполное окисление метана на катализаторах или без катализаторов под давлением.
Из перечисленных способов промышленностью ранее было освоено получение метанола сухой перегонкой древесины. Этот метод, еще 80 лет назад бывший единственным освоенным процессом, в настоящее время потерял свое промышленное значение и вытеснен синтезом метанола из оксидов углерода и водорода на катализаторах.
Производство метанола из оксида углерода и водорода является в настоящее время основным методом его синтеза. Впервые оно было осуществлено в Германии в 1923 г. Процесс проводился под давлением 25-35 МПа на цинк-хромовом катализаторе при температурах 320-380оС.
В 60-х годах XX века в Англии фирмой ICI был разработан и освоен промышленностью синтез метанола на медьсодержащем катализаторе под давлением около 5 МПа.
В 70-е годы в связи с разработкой крупных агрегатов производства метанола мощностью 400-750 тыс. тонн в год давление стадии синтеза при использовании медьсодержащих катализаторов было поднято до 8-10 МПа.
Процесс синтеза метанола может осуществляться по циркуляционной или проточной схеме при разных рабочих давлениях; в реакторах адиабатического типа с холодными байпасами между полками или в изотермических реакторах с отводом тепла из зоны реакции с помощью охлаждающей жидкости.
Настоящее учебно-методическое пособие позволяет осуществить расчёт агрегата синтеза метанола по циркуляционной схеме в полочных реакторах (колоннах) адиабатического типа с подачей охлаждающих байпасов между полками, а также расчёт агрегата синтеза метанола по циркуляционной схеме с осуществлением экзотермической реакции синтеза при фиксированной температуре за счёт отвода тепла кипящей водой из зоны реакции. Отметим, что синтез-газ (смесь СО и Н2 и небольшим количеством СО2) может быть получен при переработке природного газа, угля, нефтяных остатков, биомассы с водяным паром или кислородом. Получение синтез-газа из метана называют конверсией метана или его реформингом.
1. Физико-химические основы процесса синтеза метанола
Основные реакции образования метанола – взаимодействие оксида и диоксида углерода с водородом.
![]() (1)
(1)
![]() (2)
(2)
Кроме того, протекает побочная реакция взаимодействия диоксида углерода с водородом (обратная реакция “водяного газа”):
![]() (3)
(3)
Также в незначительных количествах образуются примеси: эфиры, высшие спирты, альдегиды и пр.
Все реакции проходят в газовой фазе с участием твердого медь- содержащего катализатора типа CuO/ZnO/Al2O3. Для стабильной работы таких катализаторов необходимо присутствие в реакционной смеси диоксида углерода.
Реакции взаимодействия оксида и диоксида углерода с водородом экзотермичны и протекают с уменьшением объема. В соответствии с принципом Ле Шателье процессу образования метанола способствует понижение температуры и повышение давления. В промышленности процесс ведут при давлении порядка 50 ÷ 100 бар в интервале температур 200÷280 оС. При более низких температурах резко падает скорость реакций образования метанола, а при более высоких снижается активность катализатора.
Реакция (2) есть сумма реакций (1) и (3), поэтому при термодинамическом анализе её можно не рассматривать. Из уравнения реакции (1) видно, что оптимальное соотношение водорода и оксида углерода составляет
![]()
Из уравнения (3) следует, что присутствие диоксида углерода в реакционной смеси ведет к снижению «эффективной» концентрации водорода и увеличению «эффективной» концентрации оксида углерода. Поэтому оптимальный состав смеси, содержащей помимо оксида углерода ещё и диоксид, характеризуется соотношением:
![]()
Выражение в левой части этого условия называют «функционалом» и обозначают через f. На практике функционал может отличаться от своего оптимального значения в зависимости от способа конверсии природного газа. Однако, нежелательно, чтобы f<2, поскольку при этом увеличивается образование вредных примесей.
Равновесие процесса синтеза метанола описывается уравнениями
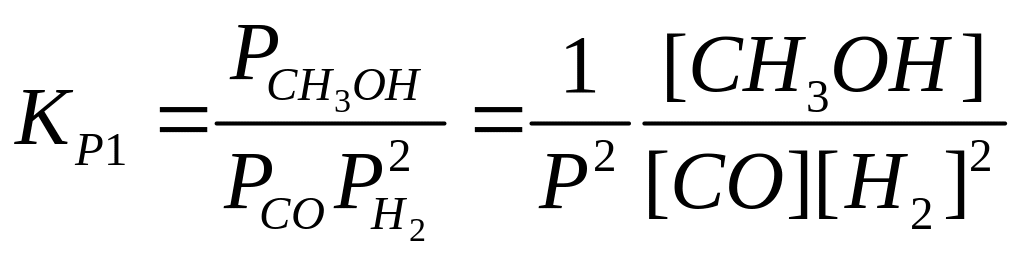 (I)
(I)
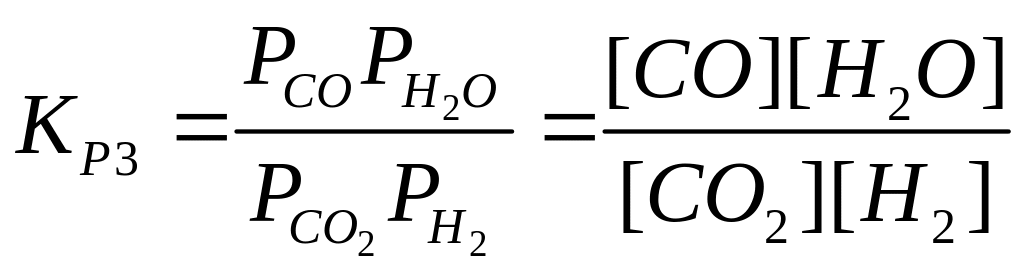 (II)
(II)
Уравнения Граафа для констант равновесия (I) и (II) в интервале давлений 9050 бар и температур 200300оС дает величины:

где R=8.314 кДж/кмоль*К; Т – температура, оК
Равновесная концентрация метанола зависит от температуры, давления и начального состава реакционной смеси, но для указанного интервала давлений и температур не превышает 10÷20 %. Поэтому для достижения достаточно высокой степени превращения исходной смеси в метанол применяют циркуляционную схему.
Для описания кинетики процесса синтеза метанола на катализаторе CuO/ZnO/Al2O3 при давлении 50 100 бар используются уравнения Граафа:
-уравнение скорости реакции (1):

- уравнение скорости реакции (2):

-уравнение скорости реакции (3):
![]()
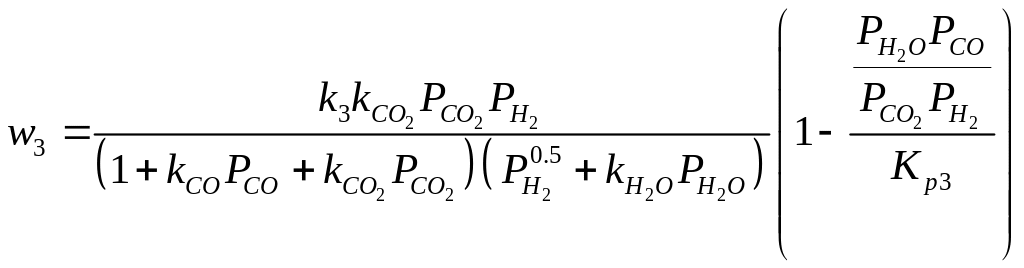
Константы скорости и адсорбционные коэффициенты зависят от температуры по закону Аррениуса.
