
БИЛЕТ 6
17.Б и о с и н т е з ж и р н ы х к и с л о т
Биосинтез жирных кислот наиболее активно происходит в цитозоле клеток пече-
ни, кишечника, жировой ткани в состоянии покоя или после еды.
Условно можно выделить 4 этапа биосинтеза:
1. Образование ацетил-S-КоА из глюкозы или кетогенных аминокислот.
2. Перенос ацетил-S-КоА из митохондрий в цитозоль.
• в комплексе с карнитином, так же как переносятся высшие жирные кислоты;
• обычно в составе лимонной кислоты, образующейся в первой реакции ЦТК.
Поступающий из митохондрий цитрат в цитозоле расщепляется АТФ-цитрат-
лиазой до оксалоацетата и ацетил-S-КоА.

3. Образование малонил-S-КоА.
4. Синтез пальмитиновой кислоты.
Осуществляется мультиферментным комплексом "синтаза жирных кислот" в со-
став которого входит 6 ферментов и ацил-переносящий белок (АПБ). Ацил-
переносящий белок включает производное пантотеновой кислоты – 6-фосфопан-
тетеин (ФП), имеющий SH-группу, подобно HS-КоА. Один их ферментов комплекса,
3-кетоацил-синтаза, также имеет SH-группу. Взаимодействие этих групп обусловливает начало биосинтеза жирной кислоты, а именно пальмитиновой кислоты, поэтому он еще называется "пальмитатсинтаза". Для реакций синтеза необходим НАДФН.
В первых реакциях последовательно присоединяются малонил-S-КоА к фосфо-
пантетеину ацил-переносящего белка и ацетил-S-КоА к цистеину 3-кетоацил-
синтазы. Данная синтаза катализирует первую реакцию – перенос ацетильной группы на С2 малонила с отщеплением карбоксильной группы. Далее в кетогруппа реакциях восстановления, дегидратации и опять восстановления превращается в метиленовую с образованием насыщенного ацила. Ацил-трансфераза переносит его на цистеин 3-кетоацил-синтазы и цикл повторяется до образования остатка пальмитиновой кислоты. Пальмитиновая кислота отщепляется шестым ферментом комплекса тиоэстеразой.
1. Именно с жирными кислотами связана самая известная функция липидов – энергетическая. Благодаря окислению жирных кислот ткани организма получают более половины всей энергии, только эритроциты и нервные клетки не используют их в этом качестве. Как энергетический субстрат используются, в основном, насыщенные и мононенасыщенные жирные кислоты.
2. Жирные кислоты входят в состав фосфолипидов и триацилглицеролов. Наличие полиненасыщенных жирных кислот определяет биологическую активность фосфолипидов, свойства биологических мембран, взаимодействие фосфолипидов с мембранными белками и их транспортную и рецепторную активность.
3. Для длинноцепочечных (С22, С24) полиненасыщенных жирных кислот установлена функция участия в механизмах запоминания и поведенческих реакциях.
4. Еще одна, и очень важная функция ненасыщенных жирных кислот, а именно – содержащих 20 углеродных атомов (эйкозановые кислоты), заключается в том, что они являются субстратом для синтеза эйкозаноидов (подробнее) – биологически активных веществ, изменяющих количество цАМФ и цГМФ в клетке, модулирующих метаболизм и активность как самой клетки, так и окружающих клеток. Иначе эти вещества называют местные или тканевые гормоны.

Пути использования жирных кислот.Жирные кислоты могут вступать в реакции только после активации. Активация жирных кислот принципиально отличается от активации углеводов.
Реакция начинается с переноса от АТФ не фосфата, а АМФ, с образованием промежуточного продукта - ациладенилата. Затем с участием HS-KoA отщепляется АМФ, и образуется активная форма любой жирной кислоты - АЦИЛ-КоА.
Образовавшийся АМФ не может превратиться в АТФ. Поэтому протекает еще одна реакция, и тоже - с затратой АТФ: АМФ + АТФ ---> 2 АДФ.
Как видно, распад 1 АТФ до АМФ энергетически равен распаду 2-х АТФ до 2-х АДФ. Поэтому затраты энергии на активацию жирной кислоты составляют 2 АТФ на одну молекулу жирной кислоты.
Для активной жирной кислоты, как и для глицерина, возможны два пути метаболических превращений.
Синтез жира или других липидов.
Катаболизм до Ацетил-КоА. Этот процесс называют бета-окисление жирных кислот.
Катаболизм жирных кислот
Активация ЖК происходит в цитоплазме, а бета-окисление - в митохондриях.
Ацил-КоА не может проходить через мембрану митохондрий. Поэтому имеется специальный механизм транспорта ЖК из цитоплазмы в митохондрию при участии вещества "карнитин". Во внутренней мембране митохондрий есть специальный транспортный белок, обеспечивающий перенос. Благодаря этому ацилкарнитин легко проникает через мембрану митохондрий.
По строению цитоплазматическая и митохондриальная карнитинацилтрасферазы различны, отличаются они друг от друга и кинетическими характеристиками. Vmax цитоплазматической ацилкарнитинтрансферазы ниже, чем Vmax митохондриального фермента, а также ниже Vmax ферментов -окисления. Поэтому цитоплазматическая ацилкарнитинтрансфераза является ключевым ферментом распада жирных кислот.
Если жирная кислота попадает в митохондрию, то она обязательно подвергнется катаболизму до ацетил-КоА.
b-окисление жирных кислот.
Процесс b-окисления является циклическим. За каждый оборот цикла от жирной кислоты отщепляется 2 углеродных атома в виде ацетильного остатка.
После этого укороченный на 2 углеродных атома ацил-КоА снова подвергается окислению (вступает в новый цикл реакций b-окисления). Образующийся Ацетил-КоА может дальше вступить в цикл трикарбоновых кислот.
Нужно уметь рассчитывать энергетический выход при распаде жирных кислот. Представленная формула верна для любой насыщенной жирной кислоты, содержащей n углеродных атомов.
При распаде ненасыщенных жирных кислот образуется меньше АТФ. Каждая двойная связь в жирной кислоте - это потеря 2-х молекул АТФ.
b-окисление наиболее интенсивно протекает в мышечной ткани, почках, печени.
В результате b-окисления ЖК образуется Ацетил-КоА. Скорость окисления определяется скоростью процессов липолиза. Ускорение липолиза характерно для состояния углеводного голодания и интенсивной мышечной работы. Ускорение b-окисления наблюдается во многих тканях, в том числе и в печени. В печени образуется больше Ацетил-КоА, чем ей требуется. Печень - "орган-альтруист" и поэтому печень отправляет глюкозу в другие ткани.
Печень стремится направить в другие ткани и свой собственный Ацетил-КоА, но не может, так как для Ацетил-КоА клеточные мембраны непроницаемы. Поэтому в печени из Ацетил-КоА синтезируются специальные вещества, которые называются "кетоновые тела". Кетоновые тела - это особая транспортная форма ацетил-КоА.
Протоплазматические - входят в состав всех структур клеток, органов и тканей и фактически остаются на одном уровне в течение всей жизни. Они составляют 25% всего жира в организме.
Резервные липиды - запасаются в организме, и их количество изменяется в зависимости от возраста, пола, условий питания, видов деятельности.
Биосинтез жирных кислот наиболее активно происходит в цитозоле клеток печени, кишечника, жировой ткани в состоянии покоя или после еды.
Условно можно выделить 4 этапа биосинтеза:
1. Образование ацетил-sКоА из глюкозы, других моносахаров или кетогенных аминокислот.
2. Перенос ацетил-sКоА из митохондрий в цитозоль:
может быть в комплексе с карнитином, также как переносятся высшие жирные кислоты, но здесь транспорт идет в другом направлении,
обычно в составе лимонной кислоты, образующейся в первой реакции ЦТК.
Поступающий из митохондрий цитрат в цитозоле расщепляется АТФ-цитрат-лиазой до оксалоацетата и ацетил-SКоА.
Оксалоацетат в дальнейшем восстанавливается до малата, и последний либо переходит в митохондрии (малат-аспартатный челнок), либо декарбоксилируется в пируват малик-ферментом ("яблочный" фермент).
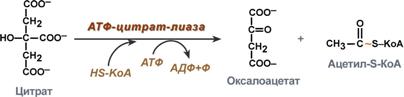
Образование ацетил-SКоА из лимонной кислоты
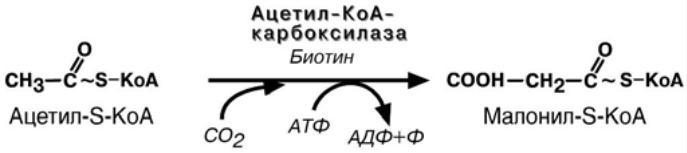
3. Образование малонил-sКоА из ацетил-sКоА.
Карбоксилирование ацетил-SКоА катализируется ацетил-SКоА-карбоксилазой, мульферментным комплексом из трех ферментов.

Образование малонил-SКоА из ацетил-SКоА
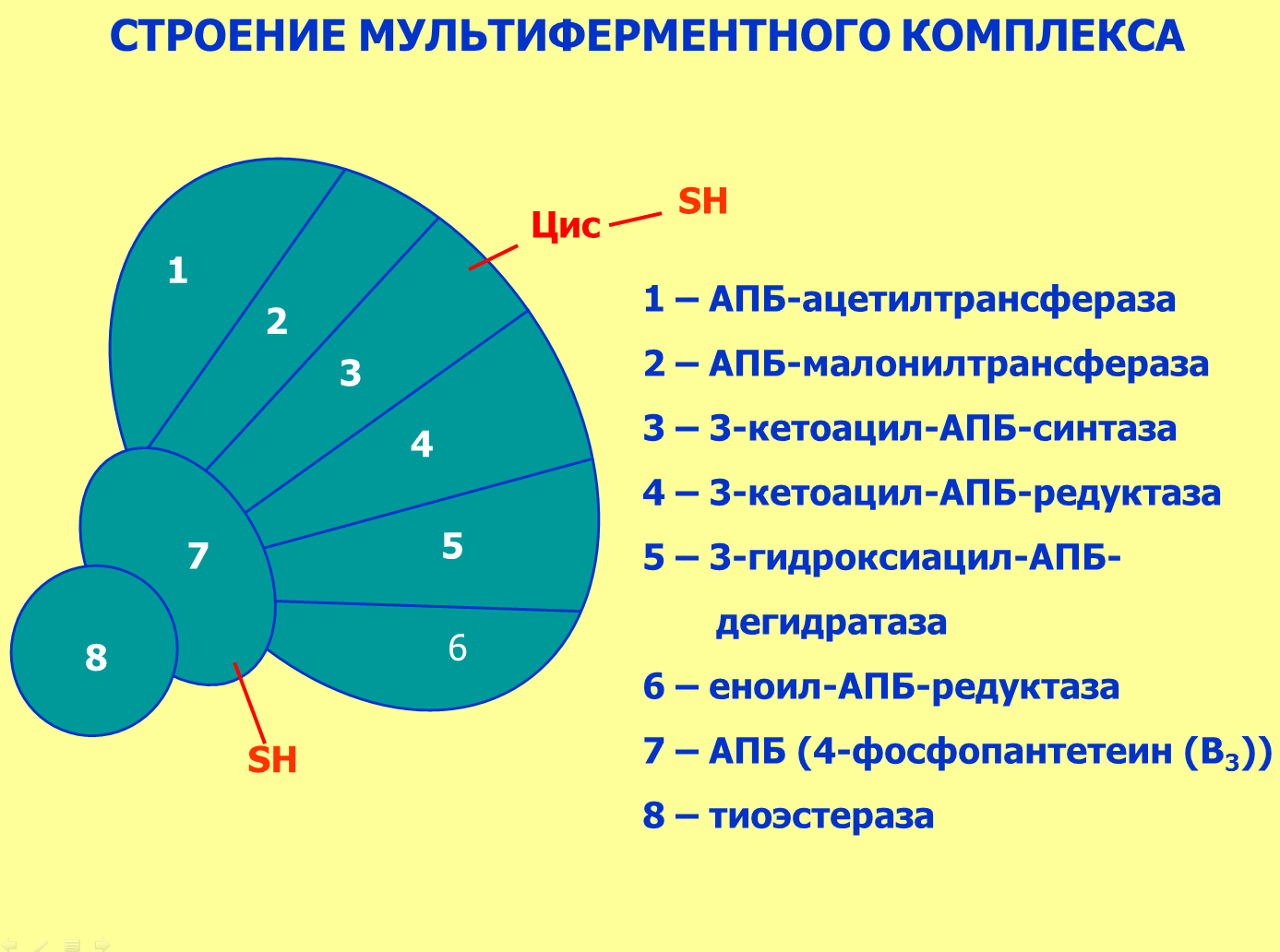
4. Синтез пальмитиновой кислоты.
Осуществляется мультиферментным комплексом "синтаза жирных кислот" (синоним пальмитатсинтаза) в состав которого входит 6 ферментов и ацил-переносящий белок (АПБ).
Ацил-переносящий белок включает производное пантотеновой кислоты – 6-фосфопантетеин (ФП), имеющий HS-группу, подобно HS-КоА. Один их ферментов комплекса, 3-кетоацил-синтаза, также имеет HS-группу в составе цистеина. Взаимодействие этих групп обусловливает начало и продолжение биосинтеза жирной кислоты, а именно пальмитиновой кислоты. Для реакций синтеза необходим НАДФН.

Активные группы синтазы жирных кислот
В первых двух реакциях последовательно присоединяются малонил-SКоА к фосфопантетеину ацил-переносящего белка и ацетил-SКоА к цистеину 3-кетоацилсинтазы.
3-Кетоацилсинтаза катализирует третью реакцию – перенос ацетильной группы на С2 малонила с отщеплением карбоксильной группы.
Далее кетогруппа в реакциях восстановления (3-кетоацил-редуктаза), дегидратации (дегидратаза) и опять восстановления (еноил-редуктаза) превращается в метиленовую с образованием насыщенного ацила, связанного с фосфопантетеином.
Ацилтрансфераза переносит полученный ацил на цистеин 3-кетоацил-синтазы, к фосфопантетеину присоединяется малонил-SКоА и цикл повторяется 7 раз до образования остатка пальмитиновой кислоты. После этого пальмитиновая кислота отщепляется шестым ферментом комплекса тиоэстеразой.

Реакции синтеза жирных кислот
Витамины - это низкомолекулярные органические вещества разнообразного строения.
Объединены в одну группу по следующим признакам.
Витамины абсолютно необходимы организму и в очень небольших количествах.
Витамины не синтезируются в организме и должны поступать извне или синтезироваться микрофлорой кишечника.
Витамины играют одинаковую роль во всех формах жизни, но высшие животные утратили способность к их синтезу. Например, аскорбиновая кислота (витамин "С") не синтезируется в организмах человека, обезьян и морской свинки, так как в процессе эволюции была утеряна ферментная система синтеза этого витамина из глюкозы.
