
- •Прикладная химия
- •Содержание
- •1. Теоретические основы коагуляции коллоидных примесей
- •1.1. Понятие о строении двойного электрического слоя
- •1.2. Устойчивость дисперсных систем
- •1.3. Понятие о гетерокоагуляции и применяемых коагулянтах
- •2. Химические методы очистки сточных вод
- •2.1. Нейтрализация
- •2.1.1. Нейтрализация смешением
- •2.1.2. Реагентная нейтрализация
- •2.1.3. Нейтрализация кислых сточных вод путем их фильтрования через нейтрализующие материалы
- •2.1.4. Нейтрализация щелочных сточных вод кислыми газами
- •2.2. Окислительный метод очистки сточных вод
- •2.2.1. Окисление реагентами, содержащими активный хлор
- •2.2.2. Окисление пероксидом водорода
- •2.2.3. Окисление кислородом воздуха
- •2.2.4. Озонирование
- •2.2.5. Окисление перманганатом калия
- •2.2.6. Радиационное окисление
- •2.3. Очистка восстановлением
- •3. Реагентные методы выделения загрязняющих веществ
- •3.1. Удаление из воды ионов марганца
- •3.2. Удаление ионов железа из поверхностных вод
- •4. Контрольное задание
- •Строение коллоидных частиц
- •Список литературы
Министерство образования и науки Астраханской области

Областное государственное образовательное учреждение
высшего профессионального образования
Астраханский инженерно – строительный институт

Кафедра Естественнонаучных дисциплин
Прикладная химия
Учебно-методическое пособие к решению задач и выполнению
контрольных работ для студентов очного и заочного обучения
специальности «Водоснабжение и водоотведение»
Астрахань
2009
Учебно-методическое пособие рекомендовано для студентов специальности водоснабжение и водоотведение инженерно-строительных высших учебных заведений. Содержит теоретический материал, задания, связанные с применением химических методов очистки сточных вод. - Астрахань, 2009. – 26 с.
Утверждено к печати на заседании кафедры «Естественнонаучных дисциплин» АИСИ
Протокол № ___ от « » 2009 г.
Утверждено на заседании МС специальности «Водоснабжение и водоотведение»
Протокол № ____ от «_____» 200__ г.
Составитель: А.С. Реснянская, к.х.н., доцент, зав. кафедрой естественнонаучных дисциплин
Рецензент: О.С. Маркова, к.б.н., доцент кафедры естественнонаучных дисциплин
© А.С. Реснянская
© ОГОУ ВПО «Астраханский инженерно-строительный институт»
Содержание
1. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ КОАГУЛЯЦИИ КОЛЛОИДНЫХ ПРИМЕСЕЙ …………………………………………………………………..……..4
1.1. Понятие о строении двойного электрического слоя…………………...5
1.2. Устойчивость дисперсных систем………………………………………6
1.3. Понятие о гетерокоагуляции и применяемых коагулянтах……...…....7
2. ХИМИЧЕСКИЕ МЕТОДЫ ОЧИСТКИ СТОЧНЫХ ВОД……………....8
2.1. НЕЙТРАЛИЗАЦИЯ………………………...……………………………8
2.1.1. Нейтрализация смешением…………………………………...…...…..9
2.1.2. Реагентная нейтрализация…………………………………..…………9
2.1.3. Нейтрализация кислых сточных вод путем их фильтрования через нейтрализующие материалы………………………………………….………….....9
2.1.4. Нейтрализация щелочных сточных вод кислыми газами……….....10
2.2. ОКИСЛИТЕЛЬНЫЙ МЕТОД ОЧИСТКИ СТОЧНЫХ ВОД…….…..11
2.2.1. Окисление реагентами, содержащими активный хлор……….….....11
2.2.2. Окисление пероксидом водорода…………………………….……...12
2.2.3. Окисление кислородом воздуха………………………………….…..13
2.2.4. Озонирование………………………………………….……………...13
2.2.5. Окисление перманганатом калия…………………………………....14
2.2.6. Радиационное окисление……………………………………………..15
2.3. ОЧИСТКА ВОСТАНОВЛЕНИЕМ…………………………………….15
3. РЕАГЕНТНЫЕ МЕТОДЫ ВЫДЕЛЕНИЯ ЗАГРЯЗНЯЮЩИХ ВЕЩЕСТВ ………………………………………………………………………….17
3.1. Удаление из воды ионов марганца…………………………………….18
3.2. Удаление ионов железа из поверхностных вод………………………19
4. Контрольное задание………………………………………………….….20
Список литературы………………………………………………………….26
1. Теоретические основы коагуляции коллоидных примесей
Коагуляция — это процесс укрупнения дисперсных частиц за счет их взаимодействия и объединения в агрегаты. Мелкие (первичные) частицы в таких агрегатах соединены силами межмолекулярного взаимодействия. Слипание однородных частиц называется гомокоагуляцией, а разнородных—гетерокоагуляцией. Вещества, способные вызвать коагуляцию частиц называют в общем случае коагуляторами, а в водоподготовке— коагулянтами или гидролизующимися коагулянтами. Последние не только вызывают коагуляцию частиц загрязнений, но и образуют, гидролизуясь, малорастворимые продукты, способные объединяться в крупные хлопья.
Дискретная фаза (твердая или жидкая) в производственных сточных водах представлена коллоидными частицами размером 0,001—0,1 мкм, мелкодисперсными частицами размером 0,1—10 мкм, а также частицами, размер которых превышает 10 мкм. В процессах механической обработки сточных вод наиболее эффективно удаляются последние из вышеперечисленных частиц. Коллоидные и мелкодисперсные частицы при механической обработке практически не удаляются, поэтому для очистки сточных вод от этих загрязнений используют различные коагулянты (чаще всего — соли алюминия и железа), которые увеличивают их скорость осаждения.
Для лиофобных золей и суспензий характерно образование на поверхности двойного электрического слоя (ДЭС) ионов и скачки потенциала на границе раздела фаз.
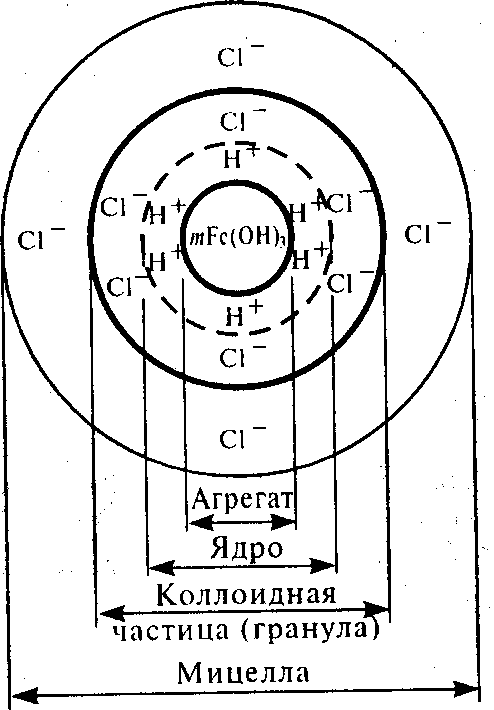
Мицелла — это структурная коллоидная частица, т. е. частица дисперсной фазы, окруженная двойным электрическим слоем. Интермицеллярной жидкостью называют дисперсионную среду, разделяющую мицеллы, в которой растворены электролиты, неэлектролиты и поверхностно-активные вещества, являющиеся стабилизаторами коллоидной системы.
Основу коллоидной частицы составляют микрокристаллы трудно растворимого Fе(ОН)3 называемые агрегатами. В результате избирательной адсорбции на поверхности агрегата образуется положительно заряженный слой, состоящий из п ионов водорода (потенциалообразующие ионы, сокращенно ПОИ). Агрегат вместе с потенциалообразующими ионами образует ядро. Под действием электростатических сил притяжения у ядра формируются слой ионов противоположного знака — противоионов, компенсирующих частично заряд ядра. В рассмотренном примере их роль выполняют ионы Сl-. Частицу с окружающим ее плотным слоем ионов называют гранулой.
Гранула характеризуется двойным электрическим слоем, который образуется из потенциалообразующих ионов и противоионов.
Следует указать, что часть противоионов (п — х), наиболее близко расположенных к ядру, находится в слое жидкости, смачивающем поверхность твердого ядра, и испытывает действие не только электростатических, но и ван-дер-ваальсовых сил ядра, поэтому прочно удерживается около него и образует так называемый адсорбционный слой противоионов (плотный слой). Остальные х противоионов слабее связаны с ядром (только электростатически) и под влиянием теплового движения располагаются в жидкой фазе диффузно и называются диффузионным слоем. Такова схема строения мицеллы. Мицеллы золей электронейтральны.
Структуру мицеллы Fе(ОН)3 можно представить следующими формулами:
Мицелла
|
|||||
{[Fе(ОН)3] Агрегат
|
nFeOCl+, FeO+ ПОИ
|
(n-x)Cl-}+ Адсорбционный слой противоионов
|
хС1- Диффуз-ный слой |
||
Ядро Ядро
|
|
|
|||
Гранула |
|
||||
Укажем также, что граница между коллоидной частицей и диффузионным слоем носит название границы или поверхности скольжения. Границы скольжения обозначают ту геометрическую поверхность, по которой происходит разделение («разрыв») мицеллы на коллоидную часть и диффузный слой в случае ее перемещения относительно дисперсионной среды.
