
- •Лекция 13. Теория молекулярных орбиталей
- •Энергетические уровни молекулярных орбиталей молекулы n2
- •Межмолекулярные силы
- •Диполь-дипольное (ориентационное) взаимодействие
- •Водородная связь
- •Температура плавления и температура кипения
- •Ковалентные твердые вещества
- •Вещества с ионной связью
- •Кристаллические решетки
Температура плавления и температура кипения
Вещество плавится, когда энергия теплового движения становится такой большой, что межмолекулярные силы больше не в состоянии удерживать молекулы рядом друг с другом.
Вещество испаряется, когда энергии теплового движения достаточно для отрыва молекул друг от друга
Таким образом, температуры плавления и кипения веществ тем выше, чем сильнее межмолекулярные силы.
Дисперсионные силы тем больше, чем больше в молекуле электронов и чем более свободно (рыхло) они располагаются. Количество электронов в молекуле приблизительно пропорционально молекулярной массе.
При сравнении веществ с близкими молекулярными массами более высокие температуры плавления и кипения будут иметь те вещества,
молекулы которых полярны или
имеют удлиненную форму, или
содержат атомы с большими радиусами.
При сравнении веществ, молекулярные массы которых различаются в разы, у веществ с большей молекулярной массой температуры плавления и кипения обычно выше.
Если молекула обладает постоянным дипольным моментом, то к дисперсионным силам добавляются диполь-дипольные взаимодействия.
Водородные связи существенно увеличивают межмолекулярные силы притяжения.

Влияние водородных связей сравнимо с 3÷10-кратным увеличением молекулярной массы.
Сравнение сил взаимодействия
Тип взаимодействия |
Энергия, кДж/моль |
Химическая связь |
~200 - 600 |
Водородная связь |
~20 - 40 |
Ориентационное (диполь-дипольное)взаимодействие |
~1 - 5 |
Индукционное взаимодействие |
~0,05 - 2 |
Дисперсионное взаимодействие |
~0,05 - 2 |
? У какого соединения самые сильные межмолекулярные силы F2, HCl, CF4?
F2 неполярная 0 D 3
HCl полярная 1,08 D 1
CF4 неполярная 0 D 2
? Оценить и описать, какие силы присутствуют и какого порядка в следующих соединениях:
Cl2, CO, CH2Cl2, HF, CH3OCH3
Cl2 Дисперсионные силы. Неполярная молекула – имеется лишь дисперсионное взаимодействие.
CO Ориентационные силы (взаимодействие диполь-дипольного типа). Молекула С-О полярна. И между полярными молекулами имеется дисперсионное взаимодействие, но силы диполь-дипольного типа значительнее, чем дисперсионного.
CH2Cl2 Ориентационные силы. Полярная молекула.
HF Водородная связь. Имеются силы дисперсионного типа и ориентационные силы, но водородная связь – самая сильная.
CH3-O-CH3 Ориентационные силы. Атомы водорода не связаны с кислородом, поэтому водородной связи здесь не возникает.Молекула полярна – имеются ориентационные силы.
Ковалентные твердые вещества
Во многих твердых веществах невозможно различать отдельные молекулы – все частички вещества связаны непрерывной решеткой ковалентных связей.
Н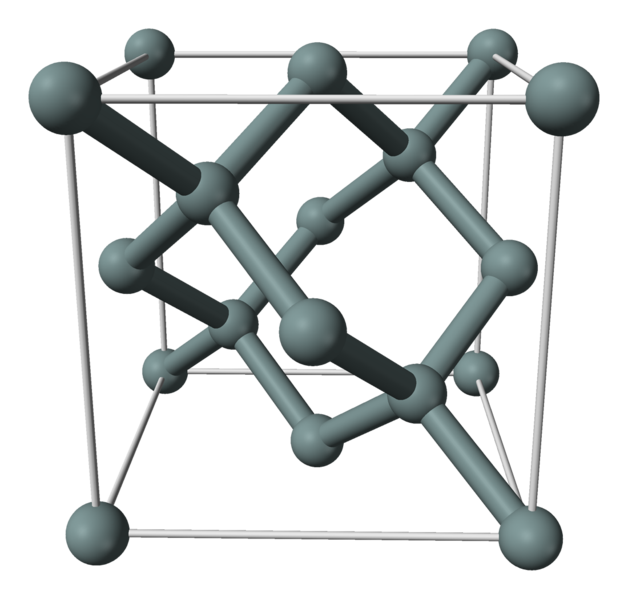 апример,
алмаз и кремний состоят из атомов,
связанных ковалентной связью в
тетраэдрическую конфигурацию:
апример,
алмаз и кремний состоят из атомов,
связанных ковалентной связью в
тетраэдрическую конфигурацию:
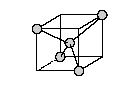
Вещества с ковалентной решеткой имеют высокие температуры плавления и кипения, так как плавление предполагает разрыв ковалентных связей.
Пример: Температура плавления алмаза более 3500 °C, кремния 1410 °C.
Подобными свойствами обладают и вещества, в которых постоянная (регулярная) решетка химических связей присутствует лишь в каком-то определенном направлении или уровне.
Н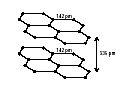 апример,
графит
состоит из слоев атомов углерода,
находящихся в состоянии sp2-гибридизации.
Внутри слоев действуют ковалентные
силы, а между слоями – силы дисперсионного
типа.
апример,
графит
состоит из слоев атомов углерода,
находящихся в состоянии sp2-гибридизации.
Внутри слоев действуют ковалентные
силы, а между слоями – силы дисперсионного
типа.
