
- •Лекция 13. Теория молекулярных орбиталей
- •Энергетические уровни молекулярных орбиталей молекулы n2
- •Межмолекулярные силы
- •Диполь-дипольное (ориентационное) взаимодействие
- •Водородная связь
- •Температура плавления и температура кипения
- •Ковалентные твердые вещества
- •Вещества с ионной связью
- •Кристаллические решетки
Лекция 13. Теория молекулярных орбиталей
Для молекул с парамагнитными свойствами для расчета химических связей неприменим метод валентных связей – например, известны вещества, в которых имеются одноэлектронные химические связи (например, молекулярные ионы H2+ и т.п.)
Теория молекулярных орбиталей (MO):
каждому электрону в молекуле соответствует определенная, распространяющаяся на всю молекулу (делокализованная) молекулярная орбиталь
для расчета молекулярных орбиталей чаще всего используют метод линейной комбинации атомных орбиталей (ЛКАО-МО):
при комбинировании некоторого числа атомных орбиталей (АО) образуется такое же количество молекулярных орбиталей (МО)
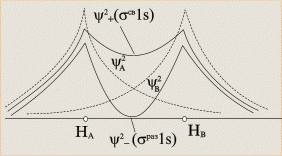
Кривые вероятности нахождения электрона на атомных (пунктир) и молекулярных (сплошные кривые) орбиталях молекулярного иона H2+
в результате линейного комбинирования двух AO получаются две МО, у одной из которых электронная плотность между атомными ядрами возрастает, а у другой – понижается - т.е. образуются соответственно связывающая МО (Ψ) и разрыхляющая МО (Ψ*)
MO обозначаются греческими буквами σ, π, δ; нижний индекс показывает исходные AO, верхний индекс – количество электронов в MO.
Пример: Из s-орбиталей образуются σ орбитали, из p-орбиталей σ- и π-орбитали
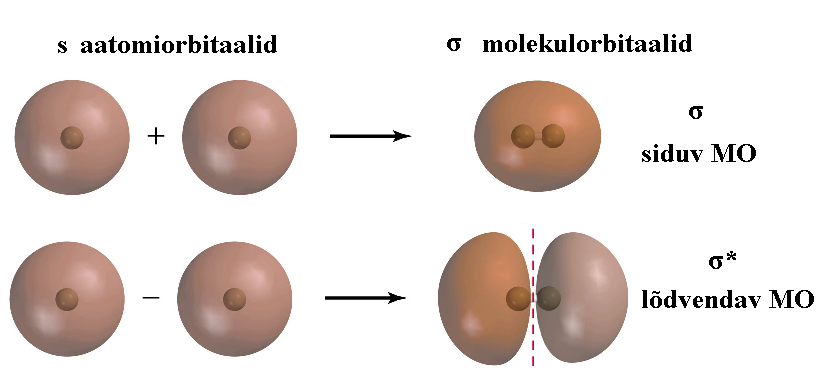


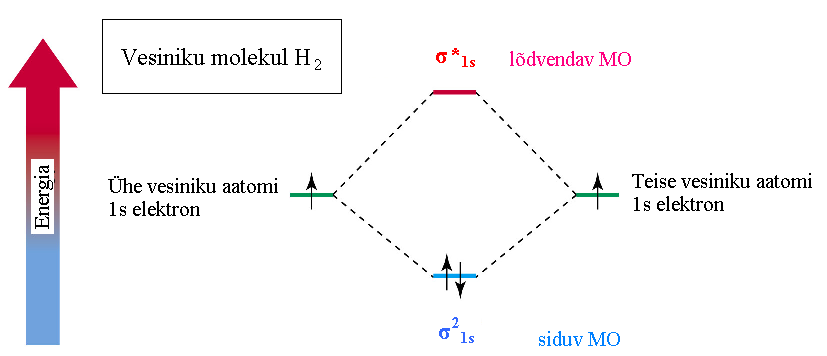
Энергия связывающей MO всегда ниже, чем энергия разрыхляющей MO.
Электроны всегда пытаются разместиться на орбитали с минимальной энергией.
На каждой MO размещаются по 2 электрона, правило Хунда и принцип Паули действуют так же как и в случае с АО.
В гомоядерных молекулах энергетические уровни MO располагаются симметрично по отношению к энергетическим уровням AO, в гетероядерных молекулах - несимметично.
П
Теория MO позволяет предсказывать стабильность молекул/ионов.
Теория MO позволяет объяснять магнитные свойства молекул/ионов.
? Разместить электроны N2 и O2 на молекулярные орбитали. Объяснить магнитные свойства кислорода и азота. Молекула фтора будет диа- или парамагнитной?
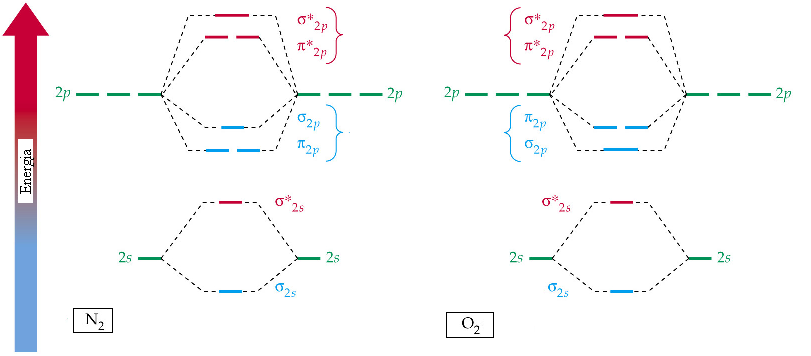

Энергетические уровни молекулярных орбиталей молекулы n2
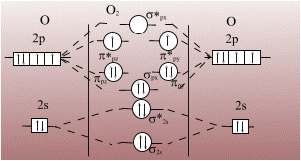
Энергетические уровни молекулярных орбиталей молекулы O2
Межмолекулярные силы
Теории химических связей объясняют, как атомы соединяются в молекулы, но трудности возникают при объяснении устойчивого сосуществования больших объемов вещества в виде жидкости или твердого вещества.
Физические свойства вещества (агрегатное состояние, температура плавления и кипения), взаимодействие твердой поверхности и жидкости, растворимость – образование гидратов в растворах – зависят от сил взаимодействия между молекулами.
Силы, действующие между нейтральными молекулами, называются силами Ван-дер-Вальса – это слабые силы электростатической природы между полярными и неполярными молекулами.
Полярные молекулы (диполи) обладают частичными положительными и отрицательными зарядами, чьи центры тяжести не совпадают между собой.
