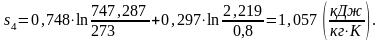- •Техническая термодинамика
- •Газовые процессы
- •1.1.1. Определение недостающих начальных параметров.
- •1.1.2. Определение недостающих конечных параметров.
- •1.1.3. Определение тепла, работы и изменения параметров внутренней энергии, энтальпии и энтропии.
- •1.2.1. Определение недостающих начальных параметров.
- •1.2.2. Определение недостающих конечных параметров.
- •1.2.3. Определение работы и изменения параметров: внутренней энергии, энтальпии и энтропии.
- •Газовые циклы.
- •2.1.1. Определение параметров газа в переходных точках цикла.
- •2.1.2. Определение тепла q, работы l и изменения параметров: внутренней энергии Δu, энтальпии Δh, энтропии Δs, в каждом процессе.
- •2.1.3. Определение полезной работы l, подведённого и отведённого тепла, кпд t (двумя способами).
- •2.2.1. Определение параметров газа в переходных точках цикла.
- •2.2.2. Определение тепла q, работы l и изменения параметров: внутренней энергии Δu, энтальпии Δh, энтропии Δs в каждом процессе.
- •2.2.3 Определение полезной работы l, кпд t (двумя способами).
- •3. Циклы паросиловых установок
- •3.1.6 Расчет термического кпд без промперегрева
- •4. Циклы трансформаторного тепла
- •4.1.1. Расчет удельной холодопроизводительности в цикле.
- •4.1.2. Расчет затраченной работы в цикле.
- •4.1.3. Расчет холодильного коэффициента в цикле.
2.2.1. Определение параметров газа в переходных точках цикла.
Найдем объем v1 из уравнения Клапейрона:
(2.76)
Для данной точки объем будет равен:
(2.77)
Где R – газовая постоянная, кДж/кг*К;
Т1 – температура в точке 1, К;
р1 – давление в точке 1, Па.
Найдем внутреннюю энергию u1.
Величина внутренней энергии газа зависит, как от скорости движения молекул и атомов, так и от расстояния между ними. Скорость движения микрочастиц вещества зависит от температуры тела, а силы взаимодействия между ними - от удельного объема. Поэтому внутреннюю энергию можно представить в виде:
(2.78)
где сv – изохорная теплоемкость газа, кДж/кгК.
Вычислим энтальпию h1.
Энтальпия газа так же, как и внутренняя энергия, зависит только от температуры. Следовательно, энтальпия h1 рассчитывается по формуле:
(2.79)
где ср – изобарная теплоемкость газа, кДж/кгК.
Найдем энтропию s1.
В уравнении первого закона термодинамики dq = du + pdv только du является полным дифференциалом внутренней энергии u. Введением множителя 1/Т можно привести это уравнение к уравнению в полных дифференциалах:
(2.80)
где ds – полный дифференциал параметра s, то есть энтропии.
Для идеальных газов pv = RT, du = cvdT, поэтому
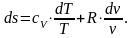 (2.81)
(2.81)
После интегрирования (2.78) получаем расчетную формулу для определения энтропии:
(2.82)
Где v1 – объем точки 1, м3/кг;
vн – объем при нормальных условиях, м3/кг.
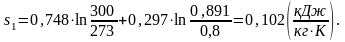
Определим параметры газа в точке 2
По изобаре 2-3 определяем, что Р2=Р3, отсюда р2=0,9 МПа.
Из условия, что процесс 1-2 является адиабатным, имеем:
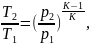 (2.83)
(2.83)
Получаем:
 (2.84)
(2.84)
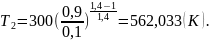
Объём найдём из уравнения Клайперона-Менделеева:
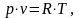 (2.85)
(2.85)
Для данной точки объем будет равен:
(2.86)
Где Т2 – температура в точке 2, К;
р2 – давление в точке 2, Па.
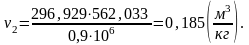
Найдем внутреннюю энергию u2 аналогично u1:
(2.87)
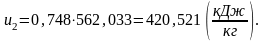
Определим энтальпию h2 аналогично h1:
(2.88)
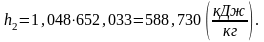
Найдем энтропию s2 аналогично s1:
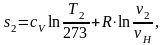 (2.89)
(2.89)
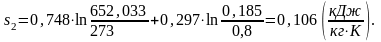
Определим параметры газа в точке 3
Найдем объем v3 аналогично v1:
(2.90)
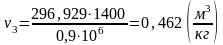 .
.
Вычислим внутреннюю энергию u3 аналогично u1:
(2.91)
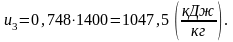
Найдем энтальпию h3 аналогично h1:
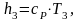 (2.92)
(2.92)
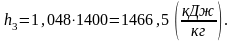
Вычислим энтропию s3 аналогично s1:
(2.93)
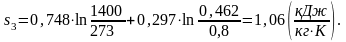
Определим параметры газа в точке 4
Так как процесс 3-4 является адиабатным:
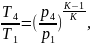 (2.94)
(2.94)
Отсюда
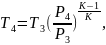 (2.95)
(2.95)
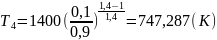 .
.
Вычислим объем v4 аналогично v1:
(2.96)
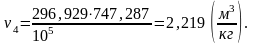
Найдем внутреннюю энергию u4 аналогично u1:
(2.97)
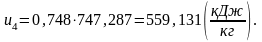
Определим энтальпию h4 аналогично h1:
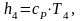 (2.98)
(2.98)
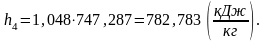
Вычислим энтропию s4 аналогично s1:
(2.99)