
- •1) Строение атома . Понятие о квантовой механике. Двойственная природа электрона. Волновая функция.
- •2) Электронная плотность. Характеристика состояния электрона системой квантовых чисел, их физический смысл.
- •4) Многоэлектронные атомы. Принцип Паули. Максимальное число электронов на энергетических уровнях и подуровнях.
- •5) Периодический закон д.И. Менделеева. Структура Периодической системы. Связь Периодической системы сос строением атома.
- •6)Атомные и ионные радиусы, энергия ионизации, срожство к электрону, электроотрицательность; их связь с Периодической системой Менделеева.
- •7) Виды химической связи. Ковалентная связь. Механизмы ее образования.
- •Механизмы образования ковалентных связей
- •8) Характеритика ковалентной связи: длина, энерния, полярность. Свойства ковалентной связи: направленность насыщаемость; валентные углы. Длина химической связи.
- •Энергия ковалентной связи
- •Валентные углы
- •9. Гибридизация волновых функций. Типы гибридизации. Пространственное строение молекулы.
- •11) Виды хим связи. Ионная связь, отличие от ковалентной. Металлическая связь
- •13) Конденисрованное состояние вещества.
- •16. Термодинамические параметры химических процессов. Энтальпия, энтропия, энергия Гиббса.
- •17) Электролитическая диссоциация. Кислоты основания соли с точки рения электролитической диссоциации.
- •18) Степень электролитической диссоциации
- •Константа диссоциации.
- •19) Диссоциация воды. Водородный показатель.
- •22) Ряд напряжений
- •24) Электрохимическая каррозия
2) Электронная плотность. Характеристика состояния электрона системой квантовых чисел, их физический смысл.
Электронная плотность
Пространственное распределение заряда электрона называется электронной плотностью. Исходя из того, что вероятность нахождения электрона в элементарном объеме dV равна |ψ|2dV, можно рассчитать функцию радиального распределения электронной плотности.
Если за элементарный объем принять объем шарового слоя толщиной dr на расстоянии r от ядра атома, то
dV = 4πr2dr,
а функция радиального распределения вероятности нахождения электрона в атоме (вероятности электронной плотности), равна
Wr = 4πr2|ψ|2dr
Она представляет собой вероятность обнаружения электрона в сферическом слое толщиной dr на определенном расстоянии слоя от ядра атома.
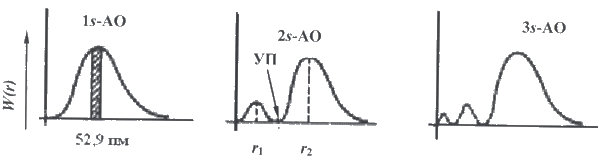
Для 1s-орбитали вероятность обнаружения электрона максимальна в слое, находящемся на расстоянии 52,9 нм от ядра. По мере удаления от ядра атома вероятность обнаружения электрона приближается к нулю. В случае 2s-орбитали на кривой появляются два максимума и узловая точка, где вероятность обнаружения электрона равна нулю. В общем случае для орбитали, характеризующейся квантовыми числами n и l, число узлов на графике функции радиального распределения вероятности равно (n − l − 1).
КВАНТОВЫЕ ЧИСЛА - энергетические параметры, определ состояние е и тип АО(атомн орбитали), на кот-ой он нах-ся.
Главное квантовое число - n - хар-ет энергию и размер АО. (т.е. определ общую эн-ию е и степень удаления его от ядра номер энергетич уровня). Принимает значения целых положит чисел от 1 до беск. Все АО с одинаковым n образуют 1 энергетич уровень (слой, оболочку). Чем > n, тем > энергия и размер АО.
Орбитальное (побочное/азимутальное) кв число - l - определ форму АО, хар-ет энергию в многоэлектронных атомах. Принимает целочисленные значения от 0 до (n-1).
l=0 - s-орбиталь. 1АО, max 2e.
l=1 - p-орбиталь. 3АО, max 6e.
l=2 - d-орбиталь. 5АО, max 10e.
l=3 - f-орбиталь. 7АО, max 14e.
Mагнитное квант число - m - хар-ся числом АО на подуровне и возможной ориентацией в пространстве. Его значения изменяются от +l до -l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО: рx, рy, рz.
Спиновое квантовое число - s - может принимать лишь два возможных значения +1/2 и -1/2. Они соответ-ют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином (от англ. веретено).
3) Многоэлектронные атомы. Последовательность энергетичесикх уровней и подуровней. Правила Клечковского. Правило Гунда. Энергетический уровень — это совокупность орбиталей, которые имеют одинаковые значения главного квантового числа. Число энергетических уровней атома равно номеру периода, в котором он расположен. Например,калий(К) -элемент четвертого периода, имеет 4 энергетических уровня (n = 4).
Энергетический подуровень — совокупность орбиталей с одинаковыми значениями главного и орбитального квантовых чисел. Энергетический подуровень обозначается латинскими буквами: s, p, d, f и т. д. Например, n = 2,1 = 0,1. Значит, на 2 уровне есть подуровень s (1 = 0) и подуровень р (1 = 1).
Электронные
формулы отображают распределение
электронов в атоме по энергетическим
уровням, подуровням (атомным орбиталям).
Электронная конфигурация обозначается
группами символов nlx , где n - главное
квантовое число, l – орбитальное квантовое
число (вместо него указывают соответствующее
буквенное обозначение –s, p, d, f), x - число
электронов в данном подуровне (орбитали).
При этом следует учитывать, что электрон
занимает тот энергетический подуровень,
на котором он обладает наименьшей
энергией – меньшая сумма n+l (правило
Клечковского). Последовательность
заполнения энергетических уровней и
подуровней следующая:
1s
→
2s →
2p →
3s →
3p →
4s →
3d →
4p →
5s →
4d →
5p →
6s →
(5d1) →
4f →
5d →
6p →
7s →
(6d1-2) →
5f →
6d →
7p
 Так
как число электронов в атоме того или
иного элемента равно его порядковому
номеру в таблице Д.И. Менделеева, то для
элемента № 16 (сера) электронные формулы
имеют вид
16S
1s22s22p63s23p4
Электронная
структура атома может быть изображена
также в виде схем размещения электронов
в квантовых (энергетических) ячейках,
которые являются схематическим
изображением атомных орбиталей (АО).
Квантовую ячейку обозначают в виде
прямоугольника, кружка или линейки
----, а электроны в этих ячейках обозначают
стрелками. В каждой квантовой ячейке
может быть не более двух электронов с
противоположными спинами, или. Орбитали
данного подуровня заполняются сначала
по одному электрону с одинаковыми
спинами, а затем по второму электрону
с противоположными спинами (правило
Хунда):
Так
как число электронов в атоме того или
иного элемента равно его порядковому
номеру в таблице Д.И. Менделеева, то для
элемента № 16 (сера) электронные формулы
имеют вид
16S
1s22s22p63s23p4
Электронная
структура атома может быть изображена
также в виде схем размещения электронов
в квантовых (энергетических) ячейках,
которые являются схематическим
изображением атомных орбиталей (АО).
Квантовую ячейку обозначают в виде
прямоугольника, кружка или линейки
----, а электроны в этих ячейках обозначают
стрелками. В каждой квантовой ячейке
может быть не более двух электронов с
противоположными спинами, или. Орбитали
данного подуровня заполняются сначала
по одному электрону с одинаковыми
спинами, а затем по второму электрону
с противоположными спинами (правило
Хунда):
1. прав Гунда (Хунда): втомная орбиталь с одинак энергией (E) запол последовательно по одному е с парал спинами, так что суммарный спин системымы максимален.
2. пртнцип наим энергии :первой заполняется орбиталь, у которой эн-ия наименьшая.
Правила Клечковского (справедливы только для заполнения АО):
1. Первой заполняется АО с наим суммой (n+l). (n1+l1)<(n2+l2). E1<E2.
2. сли сумма (n+l) одинакова, первой заполняется АО с наим знач n. (n1+l1)=(n2+l2). n1<n2. E1<E2
Нарушения правил Клечковского возможны. Проскак е-ов характерно для: Cu, Cr, Ag, Nb, Ma, Ru, Rh, Pd, Au, Pt.
