
- •1) Строение атома . Понятие о квантовой механике. Двойственная природа электрона. Волновая функция.
- •2) Электронная плотность. Характеристика состояния электрона системой квантовых чисел, их физический смысл.
- •4) Многоэлектронные атомы. Принцип Паули. Максимальное число электронов на энергетических уровнях и подуровнях.
- •5) Периодический закон д.И. Менделеева. Структура Периодической системы. Связь Периодической системы сос строением атома.
- •6)Атомные и ионные радиусы, энергия ионизации, срожство к электрону, электроотрицательность; их связь с Периодической системой Менделеева.
- •7) Виды химической связи. Ковалентная связь. Механизмы ее образования.
- •Механизмы образования ковалентных связей
- •8) Характеритика ковалентной связи: длина, энерния, полярность. Свойства ковалентной связи: направленность насыщаемость; валентные углы. Длина химической связи.
- •Энергия ковалентной связи
- •Валентные углы
- •9. Гибридизация волновых функций. Типы гибридизации. Пространственное строение молекулы.
- •11) Виды хим связи. Ионная связь, отличие от ковалентной. Металлическая связь
- •13) Конденисрованное состояние вещества.
- •16. Термодинамические параметры химических процессов. Энтальпия, энтропия, энергия Гиббса.
- •17) Электролитическая диссоциация. Кислоты основания соли с точки рения электролитической диссоциации.
- •18) Степень электролитической диссоциации
- •Константа диссоциации.
- •19) Диссоциация воды. Водородный показатель.
- •22) Ряд напряжений
- •24) Электрохимическая каррозия
24) Электрохимическая каррозия
Коррозия Металла – это их самопроизвольное разрушение под воздействием окружающей среды. Причиной его является термодинамическая неустойчивость Металла- восстановителя по отношению к окислителям, присутствующим в среде. Коррозию по механическому взаимодействию Металлов со средой подразделяют на: химическую, электрохимическую, биологическую и радиационную.
Химическая коррозия – окисление Металлов, не сопровождающееся возникновением эл тока. Такой механизм наблюдается при взаимодействии Металлов с агрессивными газами при высоких t(газов коррозия) и с органическими жидкостями неэлектролитами.
Электрохимическая коррозия – разрушение Металлов в среде электролита с возникновением внутри системы эл тока. По механизму электрохимическая коррозия протекает атмосферная, почвенная, коррозия природными речными, морскими водами, электрокоррозия блуждающими точками. Электрохимическое взаимодействие слагается из анодного окислителя и катодного восстановителя. Процесс анодного растворения металла и составляет суть электрохимической коррозии. На поверхности Металлических конструкций самопроизвольно возникают локальные микрогальванические элементы— гальванопары. Из-за малого расстояния м/у электродами электрическое сопротивление их мало, поэтому даже небольшая удельная электрическая проводимость раствора в состоянии обеспечить деятельность микропар. Участки с более ЭО-ным потенциалом окажутся анодами (по отношению к внутреннему участку цепи) и начнут растворяться, а на более Электро положит (катодах) будет происходить восстановление, что замедлит или полностью прекратит их собственную коррозию.
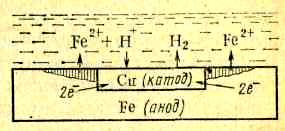 схема
коррозии железа с включением меди.
Электрохим сист этой гальванопары в
электролите H2SO4
изображается схемой Fe|H2SO4|Cu,
железо — анод, медь — катод: Fe—2ẽ
= Fe2+
(на аноде); 2Н++2ẽ=Н2
(на катоде). В рез-те железо разрушается
в месте контакта, а на меди выделяется
водород.
схема
коррозии железа с включением меди.
Электрохим сист этой гальванопары в
электролите H2SO4
изображается схемой Fe|H2SO4|Cu,
железо — анод, медь — катод: Fe—2ẽ
= Fe2+
(на аноде); 2Н++2ẽ=Н2
(на катоде). В рез-те железо разрушается
в месте контакта, а на меди выделяется
водород.
В процессе коррозии электроды гальванопары поляризуются вследствие перехода ẽ-ов с анода на катод. Явление поляризации заключается в сближении потенциалов катода, который понижается, и анода, который повышается, и приводит к замедлению коррозии. В процессе действия гальванопары результат поляризации – понижение ЭДС.
25) ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (реакции окисления-восстановления), химические реакции, сопровождающиеся изменением степени окисления атомов, входящих в состав реагирующих веществ. Первоначально окислением назывались только реакции веществ с O2, а восстановлением — реакции, в результате которых вещество теряло атом кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций распространилось и на реакции без участия кислорода.
В неорганической химии окислительно-востановительные реакции формально рассматриваются как перемещение электронов от атома одного реагента к атому другого. Вещество, в котором степень окисления атома понижается за счет приобретения электронов, называется окислителем (здесь HClO3), а вещество, в котором степень окисления атомов повышается за счет отдачи электронов — восстановителем (здесь H2SO3). При этом, окислитель восстанавливается, а восстановитель окисляется.
В органической химии окисление обычно рассматривают как процесс, в результате которого из-за перехода электрона от органического соединения к окислителю восрастает число или кратность кислородсодержащих (C-O, N-O, S-O) или уменьшается число водородсодержащих (C-H, N-H, S-H) связей. При восстановлении органических соединений в результате приобретения электронов происходят обратные процессы.
Кислая среда, там, где не хватает кислорода, добавляем соответствующее количество воды, а в противоположную добавляем соответствующее количество иона водорода.
Щелочная среда, уравниваем ОН группами и молекулами воды. Там где не хватает кислорода ставим в 2 раза больше ОН групп, а в противоположную сторону необходимое количество молекул воды.
Нейтральная среда, смотрим на продукты реакции, если продуктом является щелочь то уравниваем как в щелочной среде, а если кислота, то как в кислой.
Реакции в кислой среде. 5K2S+4O3 + 2KMn+7O4 + 3H2SO4 = 6K2S+6O4 + 2Mn+2SO4 + 3H2O
Mn+7 + 5ē = Mn+2 |
2 |
S+4 – 2ē = S+6 |
5 |
MnO4- + 8H+ + 5ē = Mn2+ + 4H2O |
2 |
SO32- + H2O – 2ē = SO42- + 2H+ |
5 |
–––––––––––––––––––––––––––––––––––––––––––––––––––
2MnO4- + 16H+ + 5SO32- + 5H2O = 2Mn2+ + 8H2O + 5SO42- + 10H+ или 2MnO4- + 6H+ + 5SO32- = 2Mn2+ + 3H2O + 5SO42-
Фиолетовый раствор KMnO4 обесцвечивается при добавлении раствора K2SO3.
Реакции в нейтральной среде 3K2S+4O3 + 2KMn+7O4 + H2O = 3K2S+6O4 +2Mn+4O2¯ + 2KOH
S+4 – 2ē = S+6 |
3 |
Mn+7 + 3ē = Mn+4 |
2 |
MnO41- + 2H2O + 3ē = MnO2 + 4OH- |
2 |
SO32- + 2OH- - 2ē = SO42- + H2O |
3 |
–––––––––––––––––––––––––––––––––––––––––––––––––––
2MnO4- + 4H2O + 3SO32- + 6OH- = 2MnO2 + 8OH- + 3SO42- + 3H2O или 2MnO4- + H2O + 3SO32- = 2MnO2 + 2OH- + 3SO42-
Фиолетовый раствор KMnO4 после окончания реакции обесцвечивается и наблюдается выпадение бурого осадка.
Реакции в щелочной среде. K2S+4O3 + 2KMn+7O4 + 2KOH = K2S+6O4 +2K2Mn+6O4 + H2O
S+4 – 2ē = S+6 |
1 |
Mn+7 + 1ē = Mn+6 |
2 |
SO32- + 2OH- - 2ē = SO42- + H2O |
1 |
MnO41- + ē = MnO42- |
2 |
–––––––––––––––––––––––––––––––––––––
SO32- + 2OH- + 2MnO4- = SO42- + H2O + 2MnO42-
Фиолетовый раствор KMnO4 превращается в зеленоватый раствор K2MnO4.
