
- •1) Строение атома . Понятие о квантовой механике. Двойственная природа электрона. Волновая функция.
- •2) Электронная плотность. Характеристика состояния электрона системой квантовых чисел, их физический смысл.
- •4) Многоэлектронные атомы. Принцип Паули. Максимальное число электронов на энергетических уровнях и подуровнях.
- •5) Периодический закон д.И. Менделеева. Структура Периодической системы. Связь Периодической системы сос строением атома.
- •6)Атомные и ионные радиусы, энергия ионизации, срожство к электрону, электроотрицательность; их связь с Периодической системой Менделеева.
- •7) Виды химической связи. Ковалентная связь. Механизмы ее образования.
- •Механизмы образования ковалентных связей
- •8) Характеритика ковалентной связи: длина, энерния, полярность. Свойства ковалентной связи: направленность насыщаемость; валентные углы. Длина химической связи.
- •Энергия ковалентной связи
- •Валентные углы
- •9. Гибридизация волновых функций. Типы гибридизации. Пространственное строение молекулы.
- •11) Виды хим связи. Ионная связь, отличие от ковалентной. Металлическая связь
- •13) Конденисрованное состояние вещества.
- •16. Термодинамические параметры химических процессов. Энтальпия, энтропия, энергия Гиббса.
- •17) Электролитическая диссоциация. Кислоты основания соли с точки рения электролитической диссоциации.
- •18) Степень электролитической диссоциации
- •Константа диссоциации.
- •19) Диссоциация воды. Водородный показатель.
- •22) Ряд напряжений
- •24) Электрохимическая каррозия
19) Диссоциация воды. Водородный показатель.
Чистая вода очень плохо проводит электрический ток, но все же обладает измеримой электрической проводимостью, которая объясняется небольшой диссоциацией воды на ионы водорода и гидроксид-ионы: H2O = H+ + OH-
По величине электрической проводимости чистой воды можно вычислить концентрацию ионов водорода и гидроксид-ионов в воде. При 25 градусах цельсия она равна 10^(-7) моль/л.
Напишем
выражение для константы диссоциации
воды:
![]()
Перепишем
это уравнение следующим образом:
![]()
Поскольку
степень диссоциации воды очень мала,
то концентрация недиссоциированных
молекул H2O в
воде практически равно общей концентрации
воды, т. е. 55,55 моль/л (1 л. содержит 1000 г.
воды, т. е. 55.55 моль).
В разбавленных водных растворах
концентрацию воды можно считать такой
же. Поэтому, заменив в последнем уравнении
произведение [H2O]
K новой
константой KH2O
будем иметь:
![]()
Полученное
уравнение показывает, что для воды и
разбавленных водных растворов при
неизменной температуре произведение
концентрата ионов водорода и гидроксид-ионов
есть величина постоянная, Эта постоянная
величина называется ионным произведением
воды. Численное значение ее нетрудно
получить, подставив в последнее уравнение
концентрации ионов водорода и
гидроксид-ионов. В чистой воде при 250C
[H+]=[OH-]=1*10-7 моль/л.
Поэтому для указанной температуры:
![]()
Растворы, в которых концентрации ионов водорода и гидроксид-ионов одинаковы, называются нейтральными растворами. При 250C, как уже сказано, в нейтральных растворах концентрация как ионов водорода, так и гидроксид-ионов равна 10-7 моль/л. В кислых растворах больше концентрация ионов водорода, в щелочных — концентрация гидроксид-ионов. Но какова бы ни была реакция раствора, произведение концентраций ионов водорода и гидроксид-ионов остается постоянным.
степень
кислотности, как и степень щелочности
раствора можно количественно
охарактеризовать концентрацией ионов
водорода:
![]()
Для измерения рН существуют различные методы. Приближенно реакцию раствора можно определить с помощью специальных реактивов, называемых индикаторами, окраска которых меняется в зависимости от концентрации ионов водорода. Наиболее распространенные индикаторы — метиловый оранжевый, метиловый красный, фенолфталеин.
Для многих процессов значение рН играет важную роль. Так, рН крови человека и животных имеет строго постоянное значение. Растения могут нормально произрастать лишь при значениях рН почвенного раствора, лежащих в определенном интервале, характерном для данного вида растения. Свойства природных вод, в частности их коррозионная активность, сильно зависят от их рН.
20) ГИДРОЛИЗ - обменная реакция между веществом и водой. Количественно характеризуется константой гидролиза и отношением числа частиц, ионов или молекул, подвергшихся гидролизу, к общему числу частиц, введенных в раствор. Основа многих природных и технологических процессов. При гидролизе солей образуются кислоты и основания, в результате чего изменяется pH среды: AlCl3 + H2O = AlOHCl2+ HCl. Благодаря гидролизу солей возможно существование буферных растворов. Гидролиз органических соединений широко используется для получения спиртов, альдегидов, кетонов, карбоновых кислот и их производных, а также галогензамещенных углеводородов. В присутствии кислот и щелочей гидролиз органических соединений значительно ускоряется.
Гидролиз соли, образованной слабой кислотой НА и сильным основанием, характеризуется константой гидролиза Kr:
Kr =[ОН-][НА]/[А-]=KH2O/Ккисл
Здесь KH2O- ионное произведение воды.
Данное соотношение показывает, что чем слабее кислота, т.е. чем меньше константа ее диссоциации, тем больше константа гидролиза образованной ею соли.
Аналогично для соли слабого основания МОН и сильной кислоты: Kr=[Н+][МОН]/[М+]=KH2O/Косн
Отсюда следует, что Kr тем больше, чем меньше Косн, т.е. чем слабее основание МОН.
Степенью гидролиза h называется доля электролита, подвергшаяся гидролизу. Она связана с константой гидролиза Kr уравнением, аналогичным закону разбавления Оствальда для диссоциации слабого электролита:
Kr =h²CM/(1-h)
Чаще всго гидролизованная часть соли очень мала, а концентрация продуктов гидролиза незначительна. В подобных случаях h «1, и в знаменателе последней формулы этой величиной можно пренебречь. Тогда связь между Kr и h выразится более простыми соотношениями: Kr =h²CM .
Из последнего уравнения следует, что степень гидролиза данной соли тем больше, чем меньше ее концентрация; иначе говоря, при разбавлении раствора гидролизирующейся соли степень ее гидролиза возрастает.
21) Гальванич эл-т - устройство, в к-ром хим энергия самопроизвольно протекающей ок-восст р-ции превращается в электрич энергию. Гальв эл-т содержит 2 полуэл-та, м/у электродами к-рых возник разность потенциалов.
Принцип работы гальв эл-та иллюстрирует гальв эл-т Даниэля-Якоби, сост из цинкового и медного полуэл-тов. В цинк. полуэл-те металлич цинк. пластина погружена в водный р-р соли цинка, с концентрацией [Zn2+]=1 моль/л. В медном полуэл-те - металлич медн пластина погружена в водн р-р соли меди (II) с концентрацией [Сu2+]=1 моль/л. Цинков и медн пластины соед-ны металлич проводником, р-ры солей - «солевым мостиком» («электролитич ключ»).
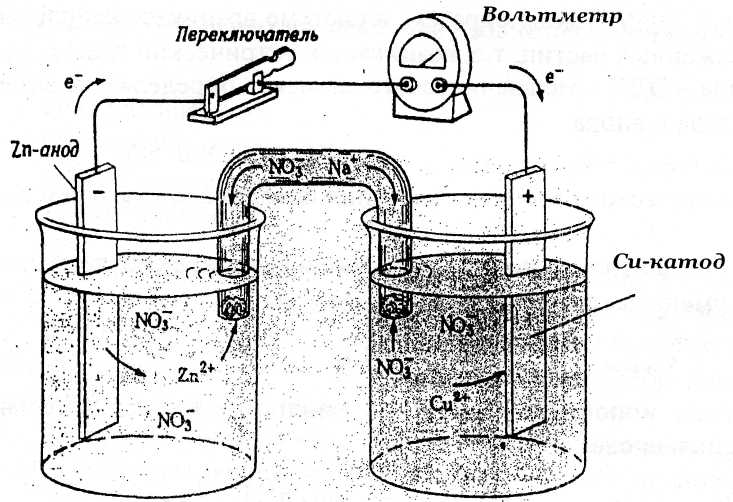
на кажд из Ме пластин на границе с р-ром уст-ся равновесия:
Cuo(тв)Сu2+(р-р)+2ẽ(на мет); φCu 2+/Cu o=+0,34B
Zno(тв)Zn2+(р-р)+2ẽ(на мет); φZn 2+/Zn o= -0,76B
Цин пластина заряжена более отриц, чем медная. М/у ними возник разность потенц. При замыкании сист в цепь равновесия на границе Ме-р-р наруш-ся. По внешн цепи(Ме проводнику)избыток ẽ-ов с Zn-плас переходит на Cu-плас, где их концентрация меньше, т.к. φZn 2+/Zn o= -0,76B<φCu 2+/Cu o=+0,34B. В рез-те равновесие на Zn-плас смещ-ся вправо, идет ок-е Ме-ческого цинка. На Cu-плас равновесие смещ-ся влево, протекает вос-е ионов меди (II):
Анод Zn(тв)- - 2e →Zn2+(p.p) (процесс ок-я)
Катод Си2+(р-р) + 2е → Си°(Тв.) (процесс вос-я)
Ион ур-е суммарной р-ции: Zn(TB.) +Cu2+(p-p)→ Zn2+(p-p) +Cu°(TB.)
Молекулярное: Zn+Cu(NО3)2→Zn(NO3)2+Cu
М/у р-рами электролитов также возник разность потенц. В цин полуэл-те в рез-те растворения цинка увелич-ся концентрация ионов Zn2+, в р-ре созд-ся избыток положит заряж ионов. В медн полуэл-те в рез-те осаждения меди концентрация ионов Си2+ уменьш-ся, и в р-ре созд-ся избыток отриц заряж ионов. По внутр цепи («солевому мостику»)катионы и анионы перемещ-ся навстречу др др. Т.о., в сист возник направленное перемещ-е заряж час-ц, т.е. возник эл ток.
ЭДС=φкатода –φанода= φCu 2+/Cu -φZn 2+/Zn=0,34 –(-0,76)=1,1В>0.
По мере работы гальв эл-та знач-я потенциалов катода и анода измен-ся.
Поскольку молярн конц-ция ионов Си2+ уменьш-ся, в соответств с Ур-ем Нернста уменьш-ся потенциал катода: φкатода= φCu 2+/Cu+RT·ln[Cu2+]/2F.
Молярн конц-ция ионов Zn2+увелич-ся, →увелич-ся потенциал анода:
φанода= φZn 2+/Zn+RT·ln[Zn2+]/2F. Т.о, по мере работы гальв эл-та ЭДС уменьш-ся, т.к. происходящие на электродах процессы приводят к выравниванию потенциалов. Сист приходит в равновесие и гальв эл-т прекращ работу.
Схема записи гальв эл-та. Для обознач-я гальв эл-та исп символич запись, упрощающую их описание.
- Zn|ZnSO4||CuSO4|Cu +
