
- •1) Строение атома . Понятие о квантовой механике. Двойственная природа электрона. Волновая функция.
- •2) Электронная плотность. Характеристика состояния электрона системой квантовых чисел, их физический смысл.
- •4) Многоэлектронные атомы. Принцип Паули. Максимальное число электронов на энергетических уровнях и подуровнях.
- •5) Периодический закон д.И. Менделеева. Структура Периодической системы. Связь Периодической системы сос строением атома.
- •6)Атомные и ионные радиусы, энергия ионизации, срожство к электрону, электроотрицательность; их связь с Периодической системой Менделеева.
- •7) Виды химической связи. Ковалентная связь. Механизмы ее образования.
- •Механизмы образования ковалентных связей
- •8) Характеритика ковалентной связи: длина, энерния, полярность. Свойства ковалентной связи: направленность насыщаемость; валентные углы. Длина химической связи.
- •Энергия ковалентной связи
- •Валентные углы
- •9. Гибридизация волновых функций. Типы гибридизации. Пространственное строение молекулы.
- •11) Виды хим связи. Ионная связь, отличие от ковалентной. Металлическая связь
- •13) Конденисрованное состояние вещества.
- •16. Термодинамические параметры химических процессов. Энтальпия, энтропия, энергия Гиббса.
- •17) Электролитическая диссоциация. Кислоты основания соли с точки рения электролитической диссоциации.
- •18) Степень электролитической диссоциации
- •Константа диссоциации.
- •19) Диссоциация воды. Водородный показатель.
- •22) Ряд напряжений
- •24) Электрохимическая каррозия
16. Термодинамические параметры химических процессов. Энтальпия, энтропия, энергия Гиббса.
Энтальпия - потенциал термодинамический, характеризующий состояние термодинамической системы при выборе в качестве основных независимых переменных энтропии S и давления р. Обозначается H (S, р, N, xl), где N — число частиц системы, xi — другие макроскопические параметры системы. Э. — аддитивная функция, т. е.энтальпия всей системы равна сумме энтальпий составляющих её частей; с внутренней энергией U системы энтальпия связана соотношением
H = U + pV,
где V — объём системы. Полный дифференциал Э. (при неизменных N и xi) имеет вид:
dH = TdS + Vdp.
Из
данной формулы можно определить
температуру
Т
и объем системы:
![]()
При
постоянном давлении (р = const.) теплоемкость
системы![]()
Эти
свойства энтальпии при р
=
const аналогичны свойствам при постоянном
объеме:
![]()
Равновесному состоянию системы в условиях постоянства S и р соответствует минимальное значение энтальпии. Изменение энтальпии (ΔН) равно количеству теплоты, которое сообщают системе или отводят от нее при постоянном давлении, поэтому значения ΔН характеризуют тепловые эффекты фазовых переходов, химических реакций и других процессов, протекающих при постоянном давлении. При тепловой изоляции тел (в условиях р = const) энтальпия сохраняется, поэтому ее называют иногда теплосодержанием или тепловой функцией.
Энтропия – мера беспорядка в системе(табличная величина). S=R lnW, где W-темодинамическая вероятность. Если вещества находятся в состоянии идеального кристалла при окислении, S=0(W=1)
Sтв<Sжид<Sгаз
аА + bB = cC + dD ∆So298 = [cSo298.C + dSo298.D ] – [aSo298.A + bSo298.B] Изменение энтропии есть разность сумм энтропий полученных элементов и суммы энтропий исходных элементов, с учетом стехометрических коэффициентов.
Каждый из процессов зависит от природы веществ и условий процесса(температура, давление, концентрация и т.д.) Сравнивая процессы можно определить направление порцесса:1) энтальпийный фактор ∆Н<0 →образ связей 2) энтропийный фактор ∆S>0 → разрыв связей, 3)химическое равновесие достигает при: ∆H=T∆S
Разница между ∆H и T∆S называется энергией Гиббса ∆σ=∆H-T∆S
Свобод энергия образования 1 моль сложного вещества из прост веществ при стандарт условиях называют стандарт свобод энергией Гиббса.(это табличная величина)
аА + bB = cC + dD 1) при стандартных условиях ∆G = [c∆Go298 обр С + d∆Go298 обр D] - [a∆Go298 исх + b∆Go298 исх ] 2) при Т: ∆GoT = ∆HoT + T∆SoT ∆HoT ≈ ∆Ho298; ∆SoT ≈ ∆So298; ∆GoT ≈ ∆Ho298 - T∆So298 3) при нестандартных условиях (по P или η) ∆GoT = ∆GoT + RTlnQ; Q = [C]c[D]d/[A]a[B]b; Q = PcC PdD / PaA PbB (парциальных Р реагентов А,В,С,D)
Условно принято, что свободная энергия образ устойчивых модификаций простых веществ при стандартных условиях равна 0(Н2, О2,Fe,C(графит)
Прямая реакция - G<0,обратная - G>0, G=0- равновесие
17) Электролитическая диссоциация. Кислоты основания соли с точки рения электролитической диссоциации.
Растворы всех веществ можно разделить на две группы: электролиты-проводят электрический ток,неэлектролиты-проводниками не являются. Это деление является условным, потому что все растворы веществ проводят электрический ток, все они в той или иной мере растворяются в воде и распадаются на катионы (положительно заряженные ионы) и анионы (отрицательно заряженные ионы). Следует различать настоящие и потенциальные электролиты. Настоящие электролиты находятся в виде ионов уже в индивидуальном состоянии, т.е. до того, как они будут расплавлены или переведены в раствор. К настоящим электролитам относятся все типичные соли, которые в твёрдом состоянии образуют ионную кристаллическую решётку (например NaCl, K2SO4 и т.д.) Потенциальные электролиты в индивидуальном состоянии ионов не содержат, но образуют их при переходе вещества в раствор. К ним относятся вещества, состоящие из молекул с сильно полярными связями (например HCl). К неэлектролитам относится большая часть органических соединений, например диэтиловый эфир, бензол, глюкоза, сахароза. Заряженные частицы появляются только в растворах и расплавах веществ вследствие электролитической диссоциации. Электролитическая диссоациация-это процесс распада веществ на ионы при растворении или расплавлении. Следовательно, в результате диссоциации в растворе появляются ионы, которые являются предпосылкой для появления у раствора или расплава такого физического свойства как электропроводимость. Как же происходит процесс растворения?. Разрушение ионной кристаллической решётки происходит под воздействием растворителя, например воды. Полярные молекулы воды настолько снижают силы электростатического притяжения между ионами в кристаллической решётке, что ионы становятся свободными и переходят в раствор. При расплавлении , когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов. Теорию электролитической диссоциации создал в 1884-1887 гг. шведский химик Аррениус .Эта классическая теория позволила как электропроводимость расплавов и растворов, так и протекание химических реакций в растворах между расплавленными или растворёнными веществами.
Схема электролитической диссоциации.
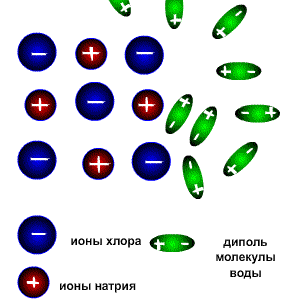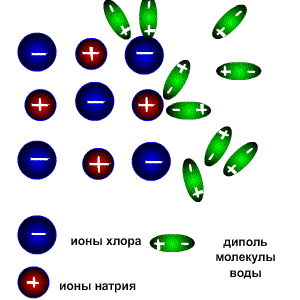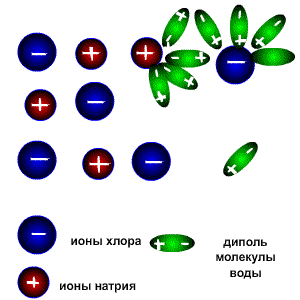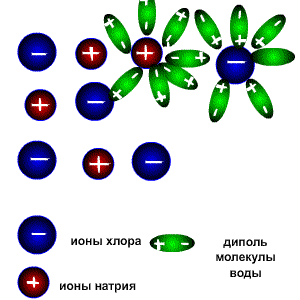
Молекулы воды являются дипольными, т.е. один конец молекулы заряжен отрицательно, другой-положительно. Молекула отрицательным полюсом подходит к иону натрия, положительным-к иону хлора; окружают ионы со всех сторон и вырывают из кристалла, причём, только с его поверхности Уравнение диссоциации можно записать следующим образом:
NaCl |
Электролитическую диссоциацию вызывает не только вода, но и неводные полярные растворители, такие как Жидкий аммиак и жидкий диоксид серы. Однако именно для воды характерно свойство ослаблять электростатическое притяжение между ионами в решётке выражено особенно ярко. Свободные ионы, оказавшиеся в водном растворе окружаются полярными молекулами воды: вокруг ионов образуется гидратная оболочка, т.е. протекает процесс гидратации.
Сила электролитов.
Силу электролитов можно охарактеризовать с помощью степени диссоциации. Степень диссоциации электролита-это частное от деления числа продиссоциированных молекул к общему числу молекул электролита, введённого в раствор.
α=Nдисс/N |
Степень диссоциации потенциальных электролитов изменяется в пределах 0< α ≤1( значение α=0 относится к неэлектролитам). Степень диссоциации возрастает при увеличении разбавления раствора, а также при повышении температуры ( повышение температуры приводит к увеличению кинетической энергии растворённых частиц, что способствует распаду молекул на ионы.) Сила электролитов в водном растворе определяется их степенью диссоциации при постоянной концентрации и температуре. К сильным электролитам относятся относятся вещества степень диссоциации которых близка к 1. К ним относятся хорошо растворимые щёлочи, соли, кислоты.
Понятие о кислотах. Константы диссоциации слабых кислот.
С точки зрения теории электролитической диссоциации, кислотами называют вещества, диссоциирующие в растворах с образованием ионов водорода. С точки зрения протонной теории кислот и оснований к кислотам относят вещества, способные отдавать ион водорода, т. е. быть донорами протонов. Наиболее характерное хим. свойство кислот – способность реагировать с основаниями с образованием солей, например:
Н2SO4+NaOH=Na2SO4+2H20
2HNO3+FeO=Fe(NO3)2+H2O
2HCl+ZnO=ZnCl2+H2O
Кислоты классифицируют по их силе, по основности и по наличию или отсутствию кислорода в составе кислоты. По силе делятся на сильные (HNO3,H2SO4,HCl и т. д.) и слабые. По основанию делятся на одноосновные (HCl, HNO3), двухосновные (H2S,H2SO4), трехосновные (H3PO4) и т. д.
Для кислот характерны следующие свойства:
а) способность взаимодействовать с основаниями с образованием кислот;
б) способность взаимодействовать с некоторыми металлами с выделением водорода,
в) способность изменять цвета индикаторов, в частности, вызывать красную окраску лакмуса;
г) кислый вкус.
У слабых кислот, диссоциирующих нацело, свойства кислот проявляются в слабой степени. Чем лучше кислота диссоциирует, т. е. чем ольше ее константа диссоциации, тем она сильнее.
pH=-lg[H+]
pH= ½ pKдис.кисл. – ½lgM кисл
Диссоциация многоосновных кислот протекает ступенчато. Т. к. K1>>K2, вторая стадия дис-ии подавлена и расчет можно производить только по первой стадии.
Понятие об основаниях. Константы диссоциации слабых оснований.
С точки зрения теории электролитической диссоциации, основаниями называют вещества, диссоциирующие в растворах с образованием гидроксид-ионов, т. е. основные гидроксиды.
Наиболее характерное свойство оснований – способность взаимодействовать с кислотами с образованием солей, например:
KOH+HCl=KCl+H2O
Ca(OH)2+CO2=CaCO3+H2O
2NaOH+ZnO=Na2ZnO2+H2O
К основаниям относятся вещества, способные присоединять ионы водорода, т. е. акцепторами протонов. Основания делят на одноосновные (LiOH,KOH,NH3 и т. д.), дикислотные (Ba(OH)2, Fe(OH)2) и т. д. По силе основания делят на сильные и слабые. К сильным относят все щелочи.
Водные растворы оснований обладают следующими общими свойствами:
а) способностью взаимодействовать с кислотами с образованием кислот;
б) способностью изменять цвета индикаторов иначе, чем их изменяют кислоты (например, они вызывают синюю окраску лакмуса);
в) своеобразным «мыльным» вкусом.
Носителем основных свойств является гидроксид-ион. Сила оснований, как и сила кислот, зависит от величины константы протолиза. Чем больше константа основности данного основания, тем оно сильнее.
Существуют гидроксиды, способные вступать во взаимодействие и образовывать соли не только с кислотами, но и с основаниями. Такие гидроксиды называют амфотерными гидроксидами, или амфотерными электролитами – амфолитами.
pOH= ½ p Кдис.осн.- ½ lgMосн
pH=14-pOH
Слабые основания диссоциируют частично. По величине Кдис.осн. можно судить о силе основания. Чем меньше Кдис.осн., тем слабее основание.
Соли. Соли можно определить как электролиты, которые при растворении в воде диссоциируют, отщепляя положительные ионы, отличные от ионов водорода, и отрицательные ионы, отличные от гидроксид-ионов. Таких ионов, которые были бы общими для водных растворов всех солей, нет; поэтому соли и не обладают общими свойствами. Как правило, соли хорошо диссоциируют, и тем лучше, чем меньше заряды ионоз, образующих соль.
Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония (NH+4) и анионы кислотных остатков.
Например, диссоциация средних солей :(NH4)2SO4 -> 2NH+4+ SO2-4; Na3PO 4 -> 3 Na + + PO 3- 4 Кислые же и основные соли диссоциируют ступенчато:
