
- •1) Строение атома . Понятие о квантовой механике. Двойственная природа электрона. Волновая функция.
- •2) Электронная плотность. Характеристика состояния электрона системой квантовых чисел, их физический смысл.
- •4) Многоэлектронные атомы. Принцип Паули. Максимальное число электронов на энергетических уровнях и подуровнях.
- •5) Периодический закон д.И. Менделеева. Структура Периодической системы. Связь Периодической системы сос строением атома.
- •6)Атомные и ионные радиусы, энергия ионизации, срожство к электрону, электроотрицательность; их связь с Периодической системой Менделеева.
- •7) Виды химической связи. Ковалентная связь. Механизмы ее образования.
- •Механизмы образования ковалентных связей
- •8) Характеритика ковалентной связи: длина, энерния, полярность. Свойства ковалентной связи: направленность насыщаемость; валентные углы. Длина химической связи.
- •Энергия ковалентной связи
- •Валентные углы
- •9. Гибридизация волновых функций. Типы гибридизации. Пространственное строение молекулы.
- •11) Виды хим связи. Ионная связь, отличие от ковалентной. Металлическая связь
- •13) Конденисрованное состояние вещества.
- •16. Термодинамические параметры химических процессов. Энтальпия, энтропия, энергия Гиббса.
- •17) Электролитическая диссоциация. Кислоты основания соли с точки рения электролитической диссоциации.
- •18) Степень электролитической диссоциации
- •Константа диссоциации.
- •19) Диссоциация воды. Водородный показатель.
- •22) Ряд напряжений
- •24) Электрохимическая каррозия
1) Строение атома . Понятие о квантовой механике. Двойственная природа электрона. Волновая функция.
Атом. Принято считать, что атом — это наименьшая химическая частица вещества, хотя, как мы знаем, каждый атом состоит из так называемых “элементарных частиц”. Атом состоит из определенного числа протонов р, нейтронов n и электронов е. Атом — наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ. Химические свойства элемента определяются строением его атома.
Атом — электронейтральная система взаимодействующих элементарных частиц, состоящая из ядра (образованного протонами и нейтронами) и электронов.
Хотя атомы образуются при взаимодействии всего лишь трех типов элементарных частиц, при их сочетании возникает большой набор разнообразных устойчивых или неустойчивых(радиоактивных!) систем.
При этом выяснилось, что всю совокупность образовавшихся таким образом атомов легко классифицировать всего лишь по одному параметру — заряду ядра z.
Электрон. Первые указания о сложном строении атома были получены при изучении процессов прохождения электрического тока через жидкости и газы. Опыты выдающегося английского ученого М. Фарадея в 30-х гг. XIX в. навели на мысль о том, что электричество существует в виде отдельных единичных зарядов.
Величины этих единичных зарядов электричества были определены в более поздних экспериментах по пропусканию электрического тока через газы (опыты с так называемыми катодными лучами). Было установлено, что катодные лучи — это поток отрицательно заряженных частиц, которые получили название электронов.
Двойственная природа электрона. В основе современной теории строения атома лежат следующие основные положения:
1. Электрон имеет двойственную (корпускулярно волновую) природу. Он может вести себя и как частица, и как волна: подобно частице, электрон обладает определенной массой и зарядом; в то же время движущийся поток электронов проявляет волновые свойства, например характеризуется способностью к дифракции. Длина волны электрона l , и его скорость u связаны соотношением де Бройля:
![]() где m
— масса
электрона.
где m
— масса
электрона.
2. Для электрона невозможно одновременно точно измерить координату и скорость. Чем точнее мы измеряем скорость, тем больше неопределенность в координате, и наоборот. Математическим выражением принципа неопределенности служит соотношение
![]() ħ
/ 2,
ħ
/ 2,
гдеD x — неопределенность положения координаты,D u — погрешность измерения скорости.
3. Электрон в атоме не движется по определенным траекториям, а может находиться в любой части околоядерного пространства, однако вероятность его нахождения в разных частях этого пространства неодинакова.
Атомные орбитали. Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, называют орбиталью.
Орбиталъ — совокупность положений электрона в атоме, т. е. область пространства, в которой наиболее вероятно нахождение электрона.
Такое понятие, как квантовая механика, зарождалось в течение долгих лет. В 1911 году ученые Н. Бор и Э. Резерфорд предложили ядерную модель атома, которая напоминала модель Коперника с его солнечной системой. Ведь солнечная система имела в своем центре ядро, вокруг которого вращались элементы. На основе этой теории начались расчеты физических и химических свойств некоторых веществ, которые были построены из простых атомов.
Одним из важных вопросов в такой теории, как квантовая механика – это природа сил, которая связывала атом. Благодаря закону Кулона, Э. Резерфорд показал, что данный закон справедлив в огромных масштабах. Затем необходимо было определить, каким образом электроны движутся по своей орбите. В этом пункте помог закон Ньютона.
Шредингер, основ-сь на постулате Де Бройля (Любая движ-ся частица обладает волновыми св-ми и мож ,быть охарактеризована длиной волны и частотой), прин-пе неопределенности Гейзенберга (Невозможно одновремен с высокой стпенью точности устанавливать координаты местоположения и величину скорости дв-ия микрочас-цы, для к-ой присущи корпускулярно-волновые св-ва) и з-не сохранения энергии электрона (е) в атоме составил ур-ие и решил его для простейшего атома H. Решениями ур-ия Шред явл энергии е в атоме и "волновые" ф-ции, зависящие от координат. Волновая ф-ция (ψi) не имеет определен физич смысла, но квадрат волновой ф-ции (ψi2) - это плотность вероятности нахождения е в точке с координатами (x,y,z) или плотность отрицательного заряда е-ного облака в данной точке ψi2∙ dV - вероятность нахождения e в объеме dV.
 Требования:
волновая ф-ция непрерывная, однозначная,
ограниченная. В рез-те точного решения
ур-ия Шред оказалось, что кажд волновой
ф-ции соответств набор 3х целочисленных
параметров - n,
l,
m
- квантовых чисел. Шред рассчитал
вероятность (W)
нахождения е на расс-нии r
от ядра в основном сост-нии атома водорода
или, иначе, распределение -ной плотности
в атоме водорода в основном состоянии.
Требования:
волновая ф-ция непрерывная, однозначная,
ограниченная. В рез-те точного решения
ур-ия Шред оказалось, что кажд волновой
ф-ции соответств набор 3х целочисленных
параметров - n,
l,
m
- квантовых чисел. Шред рассчитал
вероятность (W)
нахождения е на расс-нии r
от ядра в основном сост-нии атома водорода
или, иначе, распределение -ной плотности
в атоме водорода в основном состоянии.
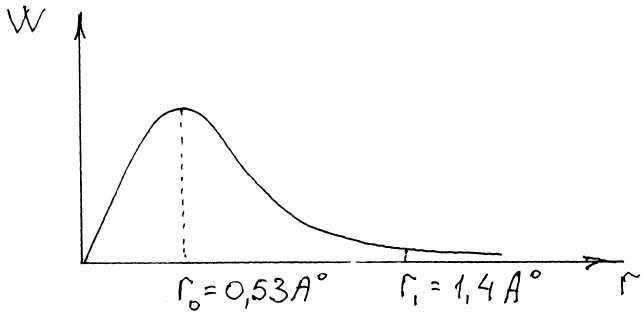
Кривая имеет экстремальный хар-р: вероят-ть нахождения е в ядре равна 0, на расст-нии r0=0,53 А0(А0=10м) достигает макс-ого знач, далее, с увелич рассn-ия (r) – уменьш-ся. Кривая асимптотически приближается к оси, но не пересекает ёё, т.е. с незначительной вероятностью е может находиться даже на бесконечном удалении от ядра, на наиболее вероятно его нахождение на r0 = 0,53 A0, кот-ое совпало с радиусом перв"стационарной орбиты" модели Бора. Обл-ть простр-ва вокруг ядра,в котор вероят-ть нахождения е составляет не менее 90%, наз атомной орбиталью. Граничная поверх-ть - это поверхность, ограничивающая атомную орбиталь. Атомная орбиталь может быть задана, охарактеризована волновой ф-цией или набром из 3х квантовых чисел - n, l, m. Атомная орбиталь, на кот-ой наход е , мож быть представлена как "облако отриц-ого заряда" или диффузное "е-ное облако". Причем, отрицат заряд е оказ неравномерно распределенным во всем объеме простр-ва вокруг ядра и плотность е-ного облака в разн точках простр-ва разл-на. Представления об е-ных облаках исп-ют в химии для объяснен образ-ния хим связей. Атомные орбитали (электрон облака) разл-ся по энергии, размерам. форме, ориентации в пространстве и могут быть охарактеризованы с помощью квант чисел.
