
- •Теоретические основы современных методов микроскопии, используемых в биологии
- •Содержание
- •Раздел 1. Оптическая микроскопия
- •Тема 1.1 Микроскопия проходящего света и стереоскопическая микроскопия
- •Вопросы для повторения
- •Тема 1.2 Изготовление препаратов для световой микроскопии
- •Вопросы для повторения
- •Тема 1.3 Конфокальная лазерная сканирующая микроскопия
- •Вопросы для повторения
- •Тема 1.4 Основные методы, используемые в конфокальной лазерной сканирующей микроскопии
- •Вопросы для повторения
- •Приложение 1. Исследования морфофункциональных особенностей биологических объектов при помощи конфокальной лазерной сканирующей микроскопии
- •Резюме по теме
- •Раздел 2 электронная микроскопия
- •Тема 2.1 Просвечивающая электронная микроскопия
- •Вопросы для повторения
- •Тема 2.2 Подготовка образцов для просвечивающей электронной микроскопии
- •Вопросы для повторения
- •Тема 2.3 Растровая (сканирующая) электронная микроскопия (рэм)
- •Вопросы для повторения
- •Тема 2.4 Подготовка образцов для растровой (сканирующей) электронной микроскопии
- •Вопросы для повторения
- •Приложение 2. Исследования морфофункциональных особенностей биологических объектов при помощи электронной микроскопии
- •Резюме по теме
- •Раздел 3 аналитическая электронная микроскопия
- •Тема 3.1 Спектральный рентгеновский микроанализ
- •Вопросы для повторения
- •Тема 3.2 Подготовка образцов для спектрального рентгеновского микроанализа
- •Вопросы для повторения
- •Приложение 3. Исследование морфофункциональных особенностей биологических объектов при помощи рентгеновского микроанализа
- •Резюме по теме
- •Раздел 4 сканирующая зондовая микроскопия
- •Тема 4.1 Атомно-силовая микроскопия
- •Вопросы для повторения
- •Тема 4.2 Методы сканирующей зондовой микроскопии
- •1. Контактные методики.
- •Вопросы для повторения
- •Тема 4.3 Факторы, влияющие на сзм - изображение
- •Вопросы для повторения
- •Приложение 4. Исследования морфофункциональных особенностей биологических объектов при помощи сканирующей зондовой микроскопии
- •Резюме по теме
- •Литература
- •Практический блок (семинарский)
- •Содержание занятий №1, №2, №3, №4
- •Содержание занятий №5, №6
- •Содержание занятия №7
- •Содержание занятия №8, №9
- •Практикум (семинарский)
- •Тематика рефератов (докладов, сообщений)
ФЕДЕРАЛЬННОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «БЕЛГОРОДСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
Центр наноструктурных материалов и нанотехнологий – центр
коллективного пользования
НИЛ физиологии адаптационных процессов
Надеждин С.В., Федорова М.З., Головко С.И.
Теоретические основы современных методов микроскопии, используемых в биологии
учебно-методическое пособие
Белгород 2007г.
Содержание
РАЗДЕЛ 1. ОПТИЧЕСКАЯ МИКРОСКОПИЯ
Тема 1.1. Микроскопия проходящего света и стереоскопическая микроскопия
Тема 1.2. Изготовление препаратов для световой микроскопии
Тема 1.3. Конфокальная лазерная сканирующая микроскопия
Тема 1.4. Основные методы, используемые в конфокальной лазерной сканирующей микроскопии
Приложение 1. Исследования морфофункциональных особенностей биологических объектов при помощи конфокальной лазерной сканирующей микроскопии
РАЗДЕЛ 2. ЭЛЕКТРОННАЯ МИКРОСКОПИЯ
Тема 2.1. Просвечивающая электронная микроскопия
Тема 2.2. Подготовка образцов для просвечивающей электронной микроскопии
Тема 2.3. Растровая (сканирующая) электронная микроскопия (РЭМ)
Тема 2.4. Подготовка образцов для растровой (сканирующей) электронной микроскопии
Приложение 2. Исследования морфофункциональных особенностей биологических объектов при помощи электронной микроскопии
РАЗДЕЛ 3. АНАЛИТИЧЕСКАЯ ЭЛЕКТРОННАЯ МИКРОСКОПИЯ
Тема 3.1. Спектральный рентгеновский микроанализ
Тема 3.2. Подготовка образцов для спектрального рентгеновского микроанализа
Приложение 3. Исследование морфофункциональных особенностей биологических объектов при помощи рентгеновского микроанализа
РАЗДЕЛ 4. СКАНИРУЮЩАЯ ЗОНДОВАЯ МИКРОСКОПИЯ
Тема 4.1. Атомно-силовая микроскопия
Тема 4.2. Методы сканирующей зондовой микроскопии
Тема 4.3. Факторы, влияющие на СЗМ - изображение
Приложение 4. Исследования морфофункциональных особенностей биологических объектов при помощи сканирующей зондовой микроскопии
Литература
Развитие знаний о морфофункциональных особенностях клеток теснейшим образом связано с успехами микроскопии и применением новых методических подходов. На сегодняшний день основными методами изучения организации биологических микрообъектов являются оптическая, электронная и сканирующая зондовая микроскопия.
Раздел 1. Оптическая микроскопия
Современные оптические микроскопы делятся на 2 класса по методу формирования изображения – классические (проходящего света) и конфокальные, на 2 типа по взаимному расположению препарата и объектива – прямые и инвертированные, а также по уровню сложности – обучающие, лабораторные и исследовательские.
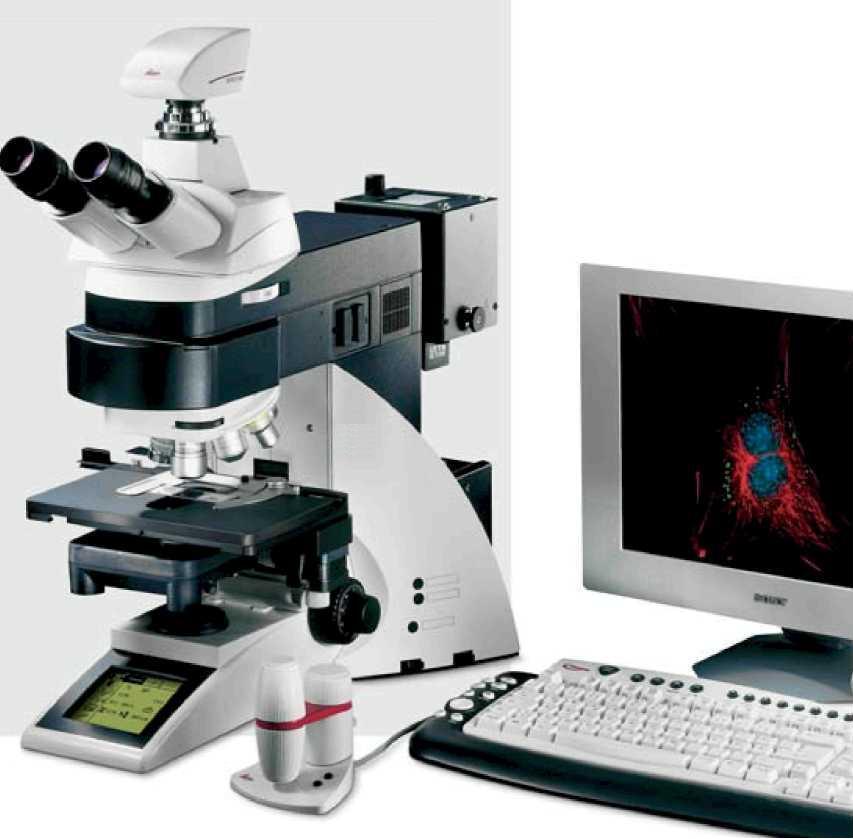
Рис.1. Современный исследовательский биологический микроскоп (фирмы Leica). Основные характеристики: галогеновый осветитель100Вт, моторизованный револьвер на 8 объективов, моторизованный конденсор, моторизованный столик, моторизованная наводка на резкость, встроенный активный ж/к экран для управления микроскопом. Может быть использован: для работы методом светлого поля, темного поля, фазового контраста, интерференционного контраста и флуоресценции.
Тема 1.1 Микроскопия проходящего света и стереоскопическая микроскопия
Цели и задачи изучения темы
Цель: формирование знаний об использовании микроскопии проходящего света и стереоскопических микроскопов в изучении биологических объектов.
Задачи:
изучение теоретических основ микроскопии проходящего света;
изучение устройства современных микроскопов проходящего света;
изучение особенностей использования стереоскопических микроскопов в биологических исследованиях;
изучение устройства и принципа работы современных стереоскопических микроскопов.
Микроскоп проходящего света это сложная оптико-механическая конструкция, имеющая осветительную, воспроизводящую и визуализирующую системы.
Осветительная часть микроскопа состоит из источника света, создающего световой поток; коллектора и конденсора. Задачей осветительной части является создание светового потока, который должен пройти через препарат и не нарушить его оптических свойств (поглощение, отражение, цветопередачу) и геометрических параметров (контура, размеров). Воспроизводящая часть - объектив, который создает увеличенное изображение препарата с максимальной достоверностью по форме, цвету и разрешению элементов. Визуализирующая часть микроскопа может состоять: из окуляра (оптического элемента проектирующего изображение препарата), системы «окуляр — оптовар» (оптовар — система дополнительного увеличения, расположенная между объективом и окуляром), адаптера (дополнительный элемент, для соединения фото-видеокамеры с микроскопом и системы «оптовар — адаптер».
Предел разрешения светового микроскопа зависит от длины световой волны, которая для видимого света лежит в диапазоне 0,38 (фиолетовый цвет) — 0,76 мкм (красный). Отсюда следует, что самыми мелкими объектами, которые можно наблюдать в световой микроскоп, являются бактерии и митохондрии (0,5 мкм). Повышение точности обработки линз не может преодолеть это ограничение, которое задано волновой природой света.
Очень важная характеристика микроскопа — предельное разрешение, позволяющее наблюдать два объекта в отдельности. Оно зависит от волновой природы света и апертуры использованной системы линз. Теоретически возможный предел составляет 0,2 мкм (при длине волны 0,4 мкм и апертуре 1,4). Это значит, что два объекта, если они разделены расстоянием менее 0,2 мкм, будут выглядеть, как одно целое.
Существующие модели классических микроскопов проходящего света (плоского поля) можно комплектовать в зависимости от методов исследования. У естествоиспытателя есть выбор между прямым или инвертированным микроскопом. Отличаются они друг от друга расположением и рабочим расстоянием объектива до объекта исследования. В прямых микроскопах объектив располагается сверху предметного столика, а рабочее расстояние составляет от 0,1 мм до 20 мм в зависимости от увеличения объектива, у инвертированных – снизу предметного столика, и с большим рабочим расстоянием от 30 до 70 мм.
На большинстве микроскопов последнего поколения (исследовательские) можно реализовать следующие методы исследования в зависимости от комплектации:
1. Светлое поле – используется для изучения окрашенных и высококонтрастных препаратов. В поле зрения на светлом фоне наблюдают контрастное однотонное или естественное цветное изображение объекта.
2. Тёмное поле и фазовый контраст – для изучения неокрашенных нативных препаратов. Изучение препаратов в темном поле осуществляется с помощью особого темнопольного конденсора. Такой конденсор пропускает от источника света только косые краевые лучи, которые освещают препарат, но не попадают в объектив. Клетки и их компоненты обладают различной оптической плотностью и по-разному рассеивают попадающие на них лучи. Рассеяние лучей вызывает свечение внутриклеточных структур. Чем плотнее структура, тем ярче она видна на темном фоне. Фазовый контраст осуществляется с помощью фазово-контрастного устройства, в состав которого входят: специальный конденсор и фазовые объективы. Метод фазового контраста основан на том, что отдельные участки прозрачного препарата отличаются от окружающей среды по показателю преломления. Свет проходит через внутриклеточные структуры с разной скоростью, что приводит к смещению фаз и изменению яркости отдельных участков.
3. Дифференциальный интерференционный контраст – для чёткой визуализации границ между объектами, различающимися по толщине и/или коэффициенту преломления. В таком микроскопе пучок параллельных световых лучей от осветителя разделяется на две ветви – верхнюю и нижнюю. Нижняя ветвь проходит через препарат, и фаза ее светового колебания изменяется, а верхняя ветвь минует препарат и остается неизменной. В призмах объектива эти ветви соединяются и интерферируют. Интерференция представляет собой результат сложения двух волн с одинаковыми периодами, но со смещенными фазами. В результате участки препарата, обладающие разной толщиной или разными показателями преломления, окрашиваются в различные цвета, становятся контрастными и хорошо видимыми. Следовательно, интерференционная микроскопия позволяет судить о толщине структур и о содержании сухого вещества в клетке.
4. Поляризационный контраст – для выявления объектов, поворачивающих плоскость поляризации. Поляризационный микроскоп является модификацией светового микроскопа, в котором установлены два поляризационных фильтра — первый (поляризатор) между пучком света, и объектом, а второй (анализатор) между линзой объектива и глазом. Через первый фильтр свет проходит только в одном направлении, второй фильтр имеет главную ось, которая располагается перпендикулярно первому фильтру, и он не пропускает свет. Получается эффект темного поля. Оба фильтра могут вращаться, изменяя направление пучка света. Если анализатор повернуть на 90° по отношению к поляризатору, то свет проходить через них не будет. Структуры, содержащие продольно ориентированные молекулы (коллаген, микротрубочки, микрофиламенты), и кристаллические структуры (в клетках Лейдига) при изменении оси вращения проявляются как светящиеся. Способность кристаллов или паракристаллических образований к раздвоению световой волны на обыкновенную и перпендикулярную к ней называется двойным лучепреломлением. Такой способностью обладают фибриллы поперечнополосатых мышц.
5. Флуоресценция - для получения изображения в микроскопе используется свет определенной длинны волны от ртутно-кварцевых или ксеноновых ламп, который вызывает флюоресценцию (люминесценцию) объекта. Отдельные молекулы вещества, поглощая фотоны света, переходят в возбужденное состояние и при переходе к исходному (нормальному) состоянию испускают кванты света, большей длинны волны на 20 – 50 нм (закон Стокса). Различают первичную и вторичную флуоресценцию. Первичная присуща ряду биологически активных веществ, таких, как ароматические аминокислоты, порфирины, хлорофилл, витамины А, В2, В1 , некоторые антибиотики (тетрациклин) и химиотерапевтические вещества (акрихин, риванол). Вторичная возникает в результате обработки микроскопируемых объектов флюоресцирующими красителями – флюорохромами. Некоторые из этих красителей диффузно распределяются в клетках, другие избирательно связываются с определёнными структурами клеток или даже с определёнными химическими веществами. Люминесцентный микроскоп снабжен мощным источником освещения с большой поверхностной яркостью, максимум излучения которого находится в коротковолновой области видимого спектра, системой светофильтров, а также интерференционной светоделительной пластинкой, применяемой при возбуждении люминесценции падающим светом. Для возбуждения флюоресценции при люминесцентной микроскопии обычно используют длинноволновую ультрафиолетовую (область спектра 0,25 – 0,4 мкм), сине-фиолетовую, а иногда и зелёную область спектра. В люминесцентном микроскопе применяют обычно стеклянную оптику и обычные предметные и покровные стёкла, пропускающие излучение в этой части спектра и не обладающие собственной люминесценцией.
Развитие микроскопических методов исследования и цифровых технологий способствовало появлению новых моделей микроскопов.
Стереоскопические микроскопы (проходящего и падающего света) предназначены для наблюдения объемного или трехмерного изображения объектов, требующих наблюдения в большой лабораторной посуде с малым увеличением (например, подсчет колоний в чашке Петри), и являются только прямыми микроскопами.
Изображения, полученные на стереомикроскопе.
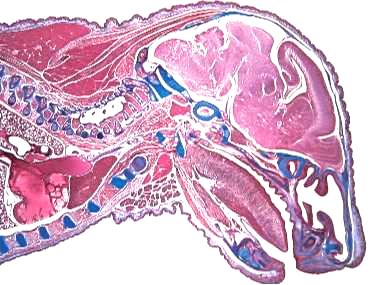
Рис. 3. Мышь в проходящем свете (продольный разрез).
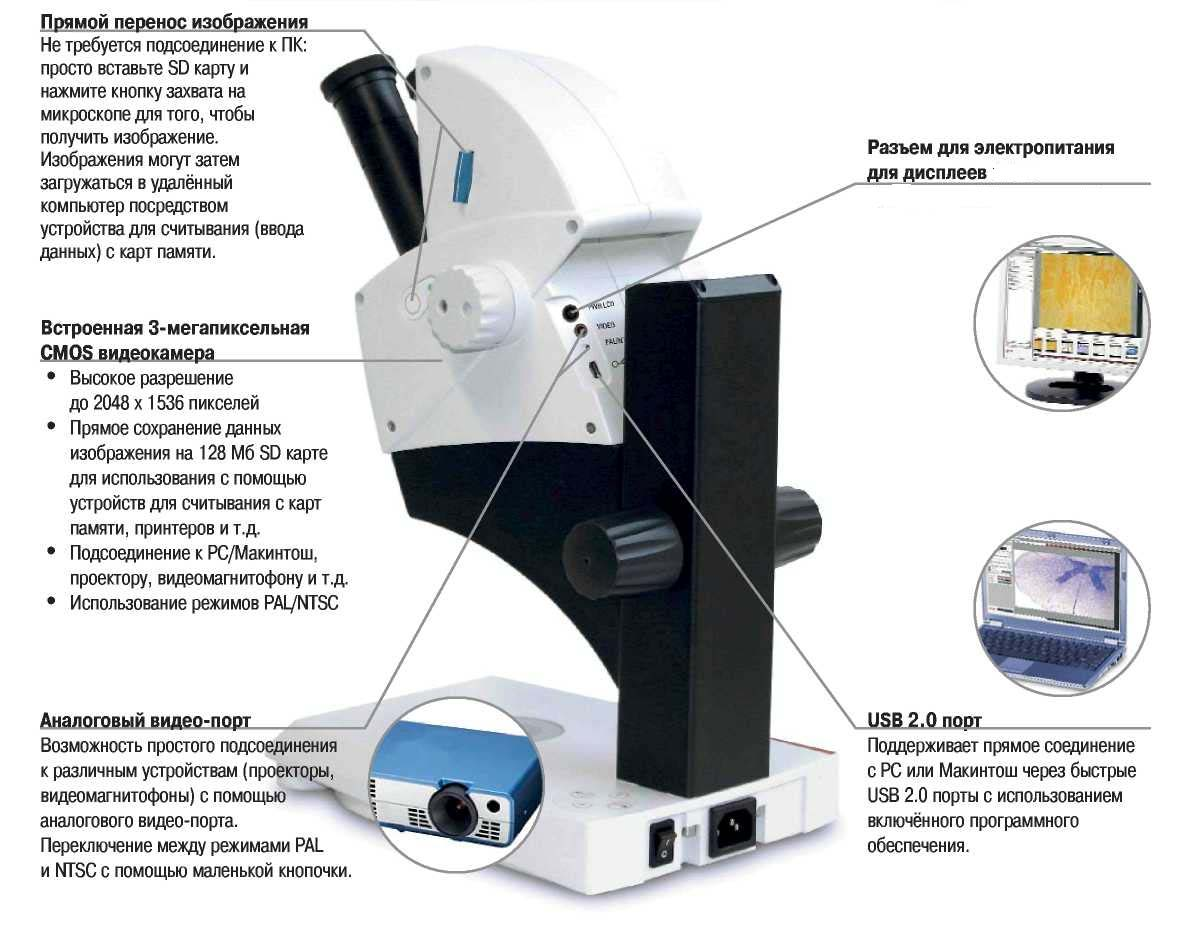
Рис.2. Современный стереомикроскоп (фирмы Leica).
Основные оптические характеристики: преобразователь увеличения – Зум 4.4:1; окуляры – 10х/20, 16х/15, 20х/12; угол наблюдения 600; рабочее расстояние – 100 мм; диапазон увеличения от 8х до 70х; максимальное разрешение 340 лин /мм; максимальная цифровая апертура 0.057 nA; диаметр поля зрения от 5.7 до 25 мм.
