
- •1.Общие представления о растворах и процессах растворения веществ.
- •2.Физические свойства разбавленных растворов. Законы Рауля и Вант - Гоффа.
- •3.Растворы электролитов. Теория электролитической диссоциации. Количественные характеристики процесса диссоциации.
- •4.Обменные реакции в растворах электролитов.
- •5.Гетерогенные процессы и равновесия в растворах.
- •6.Современные представления о кислотах и основаниях.
6.Современные представления о кислотах и основаниях.
1. Классическая теория электролитической диссоциации была создана С. Аррениусом и В. Оствальдом в 1887 году. Аррениус придерживался физической теории растворов, не учитывал взаимодействие электролита с водой и считал, что в растворах находятся свободные ионы. Русские химики И. А. Каблуков и В. А. Кистяковский применили для объяснения электролитической диссоциации химическую теорию растворов Д. И. Менделеева и доказали, что при растворении электролита происходит его химическое взаимодействие с водой, в результате которого электролит диссоциирует на ионы.
Классическая теория электролитической диссоциации основана на предположении о неполной диссоциации растворённого вещества, характеризуемой степенью диссоциации α, т. е. долей распавшихся молекул электролита. Динамическое равновесие между недиссоциированными молекулами и ионами описывается законом действующих масс . Например, электролитическая диссоциация бинарного электролита KA выражается уравнением типа:
![]()
Константа диссоциации Kd определяется
активностями катионов
![]() , анионов
, анионов
![]() и недиссоциированных молекул
и недиссоциированных молекул
![]() следующим образом:
следующим образом:
![]()
Значение Kd зависит от природы растворённого вещества и растворителя, а также от температуры и может быть определено несколькими экспериментальными методами. Степень диссоциации (α) может быть рассчитана при любой концентрации электролита с помощью соотношения:
![]()
Где
![]() — средний коэффициент активности
электролита.
— средний коэффициент активности
электролита.
2. Существует 3 теории кислот и оснований — их создали Аррениус, Сванте Август, Брёнстед, Йоханнес Николаус и Льюис, Гилберт Ньютон.
Теория Бренстеда
Согласно теории Бренстеда, кислота — это соединение, способное отдавать основанию катионы водорода Н+ (является донором Н+). Основания — это соединения, способные принимать у кислоты катионы водорода Н+ (является акцептором Н+). Таким образом, в этой теории одно и то же вещество в зависимости от взаимодействия может быть и кислотой, и основанием. Например, вода при взаимодействии с протоном H2O + H+ = H3О+ является основанием, а реагируя с аммиаком NH3 + H2O = NH4+ + OH- является кислотой.
Протонная теория объясняет кислотные и оснoвные свойства веществ происходящими между ними процессами протолиза - обмена протонами.
3. Теория Бренстеда - Лоури
Согласно теории Бренстеда - Лоури кислота рассматривается как вещество, поставляющее протон, а основание - как вещество, способное присоединять протон (1,2)
А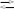 В +Н +
(1)
В +Н +
(1)
Кислота и отвечающее ей основание, таким образом, образуют сопряженную пару.
Ключевым в теории Бренстеда - Лоури является представление о том, что кислота взаимодействует при переносе протона с другой сопряженной парой (двойное протолитическое равновесие):
А 1+ В2 А2 + В1 (2)
Отсюда вытекают и первые предпосылки для количественного сравнения силы кислот и оснований: сильная кислота отдает протон ”легче”, чем слабая, а сильное основание “крепче” связывает протон, чем слабое. Равновесие тем полнее сдвинуто вправо, чем сильнее кислота А1 и слабее кислота А2 .
Можно представить, что двойное протолитическое равновесие является результатом двух сопряжённых равновесий:
Н А Н+ + А (3)
В + Н+ ВН+ (4)
Уравнение (4) лежит в основе количественной теории .позволяющей сравнивать силу различных оснований.
Безусловно, схема кислотно-основного равновесия, сформулированная Бренстедом и Лоури, не полностью отражает истинный процесс. Вернее, уравнение (4) следует считать адекватным процессам, происходящим в газовой фазе, что само по себе достаточно ценно и важно. В растворах же реакция между кислотой и основанием не сводится только к переносу протона от кислоты к основанию. Сначала кислота АН и основание В образуют комплекс АН...В за счет водородной связи между водородом кислоты и электронодонорным атомом основания. Во многих случаях протолитическая реакция преимущественно ограничивается этой начальной стадией комплексообразования. Поэтому такой процесс называется "незавершенным" кислотно-основным равновесием [4]. Следовательно, образование водородных связей рассматривается не только как вспомогательная, переходная ступень при кислотно-основном взаимодействии, облегчающая переход протона от кислоты к основанию, но и как один из самостоятельных видов этого взаимодействия. В благоприятных условиях кислотно-основное взаимодействие не останавливается на стадии комплекса АН...В, и происходит передача протона от кислоты к основанию, в результате чего основание протонируется. Эта вторая стадия цротолитического процесса называется "завершенным" кислотно-основным взаимодействием. При этом образовавшиеся ионы могут находиться в растворе либо в свободном виде, либо в виде ионных пар:
В Н+А ВН+ | | А ВН+ + А, (5)
где ВН+А- - тесные ионные пары; ВН+ А- сольватно-разделеные ионные пары ; ВН+ и А-свободные ионы.
Более полным отражением кислотно-основного процесса является следующая схема [4]:
А Н + В а АН...В б А...ВН+ в А + ВН+, (6)
здесь а - незавершенное кислотно-основное равновесие, б - завершенное и в - диссоциация на свободные ионы*. Таким образом, количественное сравнение слабых оснований в рамках теории Бренстеда - Лоури должно осуществляться с учетом реальной ситуации, в которой происходит перенос протона к органическому основанию: в газовой фазе основой для количественных расчетов основности может служить принципиальная схема (4), тогда как в растворах следует опираться на схему (6), а вернее, на ее модификации, учитывающие конкретные условия.
К недостаткам теории Бренстеда следует отнести то обстоятельство, что реакции с участием апротонных кислот исключаются из круга кислотноосновных равновесий.
4. Теория кислот и оснований Льюиса
Основная статья: Апротонная кислота
В теории Льюиса было еще более расширено понятие кислоты и основания. Кислота — это молекула, имеющая вакантные электронные орбитали, вследствие чего она способна принимать электронные пары, например BF3, AlCl3. Основание — это молекула, способная быть донором электронных пар. Например, основания Льюиса — все анионы, аммиак и амины, вода, спирты, галогены.
** для равновесия в возможна более сложная картина, предусмотренная схемой (5)
