
- •1.Общие представления о растворах и процессах растворения веществ.
- •2.Физические свойства разбавленных растворов. Законы Рауля и Вант - Гоффа.
- •3.Растворы электролитов. Теория электролитической диссоциации. Количественные характеристики процесса диссоциации.
- •4.Обменные реакции в растворах электролитов.
- •5.Гетерогенные процессы и равновесия в растворах.
- •6.Современные представления о кислотах и основаниях.
3.Растворы электролитов. Теория электролитической диссоциации. Количественные характеристики процесса диссоциации.
1. Классическая теория электролитической диссоциации была создана С. Аррениусом и В. Оствальдом в 1887 году. Аррениус придерживался физической теории растворов, не учитывал взаимодействие электролита с водой и считал, что в растворах находятся свободные ионы. Русские химики И. А. Каблуков и В. А. Кистяковский применили для объяснения электролитической диссоциации химическую теорию растворов Д. И. Менделеева и доказали, что при растворении электролита происходит его химическое взаимодействие с водой, в результате которого электролит диссоциирует на ионы.
Классическая теория электролитической диссоциации основана на предположении о неполной диссоциации растворённого вещества, характеризуемой степенью диссоциации α, т. е. долей распавшихся молекул электролита. Динамическое равновесие между недиссоциированными молекулами и ионами описывается законом действующих масс . Например, электролитическая диссоциация бинарного электролита KA выражается уравнением типа:
![]()
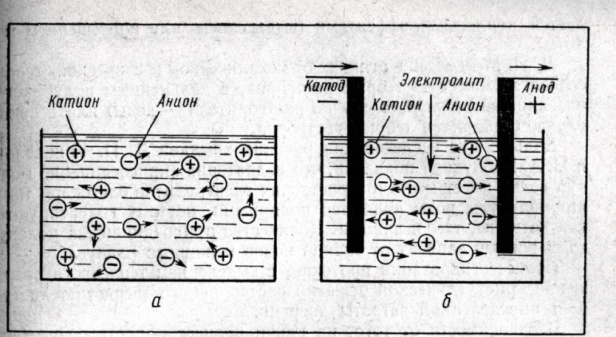
2. Электроли́т — химический термин, обозначающий вещество, расплав или раствор, который проводит электрический ток вследствие диссоциации на ионы. Примерами электролитов могут служить кислоты, соли и основания. Электролиты — проводники второго рода, вещества, которые в растворе (или расплаве) состоят полностью или частично из ионов и обладающие вследствие этого ионной проводимостью.
Если какой-либо раствор подчиняется законам идеальных растворов при любых концентрациях, то его называют совершенный раствор. Если раствор начинает подчиняться законам идеальных растворов только при достаточно большом разведении, то это бесконечно разбавленный раствор (концентрация растворенного вещества стремится к нулю). Во всех прочих случаях раствор считается реальным.
Все растворы электролитов - реальные растворы, так как растворяемое вещество в них диссоциирует на ионы. Законы Рауля для этих растворов не выполняются, даже в случае бесконечно разбавленных растворов.
В случае растворов не электролитов - чем более разбавлен раствор, тем ближе его свойства к идеальному. Однородные смеси неполярных веществ (углеводородов) близки к идеальным растворам при всех концентрациях.
3. Основной причинами электролитической диссоциации являются, с одной стороны, взаимод. растворенного в-ва с р-рителем, к-рое приводит к сольватации ионов, а с другой стороны - значит. ослабление электро-статич. взаимод. между сольватир. ионами в среде, обусловленное ее электростатич. полем (диэлектрич. проницаемостью р-рителя). При этом работа, необходимая для разрушения молекул (кристаллич. решетки), обеспечивается за счет энергии сольватации.
Электролитическая диссоциация лежит в основе деления р-ров на два класса - растворы неэлектролитов и растворы электролитов. Наблюдаемое различие в коллигативных св-вах разбавленных р-ров электролитов и неэлектролитов объясняется тем, что из-за электролитической диссоциации увеличивается общее число частиц в р-ре. Это, в частности, приводит к увеличению осмотич. давления р-ра сравнительно с р-рами неэлектролитов, понижению давления пара р-рителя над р-ром, увеличению изменения т-ры кипения и замерзания р-ра относительно чистого р-рителя. Электролитическая диссоциация объясняется также ионная электропроводность электролитов.
Диссоциация солей:
С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода
Н3РО4 Н+ + Н2РО-4(первая ступень)
Н2РО-4 Н+ + НРO2-4 (вторая ступень)
НРО2-4 Н+ PОЗ-4 (третья ступень)
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени - по третьей. Поэтому в водном растворе, например, фосфорной кислоты наряду с молекулами Н3РО4 имеются ионы (в последовательно уменьшающихся количествах) Н2РО2-4, НРО2-4 и РО3-4.
Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония ( NH+4) и анионы кислотных остатков
Например:
(NH4)2SO4 2NH+4 + SO2-4; Na3PO4 3Na+ + PO3-4
Так диссоциируют средние соли. Кислые же и основные соли диссоциируют ступенчато. У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода. Например:
KHSO4 K+ + HSO-4
и далее
HSO-4 H++SO2-4
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы.
Mg(OH)Cl Mg(OH)++Cl-
и далее
Mg(OH)+ Mg2++OH-
4.
5. Электроли́т — химический термин, обозначающий вещество, расплав или раствор, который проводит электрический ток вследствие диссоциации на ионы. Примерами электролитов могут служить кислоты, соли и основания. Электролиты — проводники второго рода, вещества, которые в растворе (или расплаве) состоят полностью или частично из ионов и обладающие вследствие этого ионной проводимостью.
Поскольку электролитическая диссоциация - процесс обратимый, то в растворах электролитов наряду с их ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации (обозначается греческой буквой альфа α).
Степень диссоциации - это отношение числа распавшихся на ионы молекул N' к общему числу растворенных молекул N:
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 или 100%, то электролит полностью распадается на ионы. Если же α = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы.
Различные электролиты имеют различную степень диссоциации. Опыт показывает, что она зависит от концентрации электролита и от температуры. С уменьшением концентрации электролита, т.е. при разбавлении его водой, степень диссоциации всегда увеличивается. Как правило, увеличивает степень диссоциации и повышение температуры. По степени диссоциации электролиты делят на сильные и слабые.
6.Сильные электролиты — химические соединения, молекулы которых в разбавленных растворах практически полностью диссоциированы на ионы.
Степень диссоциации таких электролитов близка к 1.
К сильным электролитам относятся многие неорганические соли, некоторые неорганические кислоты и основания в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью (спирты, амиды и др.).
Слабые электролиты — химические соединения, молекулы которых даже в сильно разбавленных растворах не полностью диссоциированы на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. К слабым электролитам относится большинство органических кислот и многие органические основания в водных и неводных растворах.
7. Полярность химических связей, характеристика химической связи,показывающая перераспределение электронной плотности в пространстве вблизи ядер по сравнению с исходным распределением этой плотности в нейтральных атомах, образующих данную связь. Количественной мерой П. х. с. служат т. н. эффективные заряды на атомах: разность между зарядом электронов, сосредоточенным в некоторой области пространства (порядка атомных размеров) вблизи ядра, и зарядом ядра. Эта мера приближённая, поскольку выделить в молекулах области, относящиеся к отдельным атомам и отдельным связям (если их несколько), однозначно нельзя. Связи строго неполярны лишь в двухатомных гомоядерных молекулах, в остальных случаях они в той или иной степени полярны. Обычно ковалентные связи слабо полярны, ионные связи сильно полярны. П. х. с. иногда указывают символами зарядов у атомов (например, Н+d — Cl-d, где d — некоторая доля элементарного заряда).
Поляризуемость химических связей. Как правило, поляризуемость молекулы считается аддитивной по хим. связям (средняя поляризуемость-также и по атомам). При аддитивном подходе каждой связи приписывается эллипсоид поляризуемости с главными полуосями вдоль связи (продольная поляризуемость bL) и в двух поперечных взаимно перпендикулярных направлениях; мол. эллипсоид поляризуемости получается как тензорная сумма связевых эллипсоидов поляризуемости с учетом расположения их осей. Если связь между частицами А и В имеет осевую симметрию, две поперечные поляризуемости bT равны между собой, анизотропия поляризуемости g(А—B) = bL(A—В)-bT(А—В). В случае двойной связи bT лежит в ее плоскости, а перпендикулярная этой плоскости составляющая поляризуемости наз. вертикальной поляризуемостью (обозначается bV). Такая связь описывается двумя параметрами анизотропии поляризуемости: g' = bL — bT, g: = bL — bV.
Концентрация и температура по принципу Ле Шателье.
8. Теория электролитической диссоциации справедлива только к растворам слабых электролитов. Сильные электролиты диссоциируют полностью, создавая значительную концентрацию ионов в растворе. Их ионы в растворах как бы окружены оболочкой полярных молекул растворителя, что приводит к уменьшению скорости движения ионов. В результате степень диссоциации меньше единицы, хотя реально в растворе присутствуют только ионы. Такую экспериментальную величину называют кажущейся степенью диссоциации.
а = (i - 1) / (k - 1)
9. Закон действующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии. Закон действующих масс сформулирован в 1864—1867 гг. К. Гульдбергом и П. Вааге. Согласно этому закону скорость, с которой вещества реагируют друг с другом, зависит от их концентрации. Закон действующих масс используют при различных расчетах химических процессов. Он позволяет решить вопрос, в каком направлении возможно самопроизвольное течение рассматриваемой реакции при заданном соотношении концентраций реагирующих веществ, какой выход нужного продукта может быть получен.
Константа диссоциации (К) определяется на основе закона действующих масс. Этот закон может быть применим к равновесию, которое устанавливается в растворе слабого электролита между молекулами и ионами. Константа диссоциации представляет собой отношение произведения концентраций ионов к концентрации недиссоциированных молекул.
Сравнение значений константы диссоциации показывает, что в наибольшей степени диссоциация многоосновных кислот и оснований протекает по первой стадии, а интенсивность каждой последующей стадии резко уменьшается. Это общая закономерность. Она объясняется тем, что энергия отрыва иона от нейтральной молекулы всегда меньше, чем энергия, которую требуется затратить для отрыва иона от заряженной частицы.
Сильные электролиты закону действующих масс не подчиняются: константы диссоциации их, вычисленные по вышерассмотренному способу, не являются постоянными величинами при разных концентрациях.
1. Деление электролитов на сильные и слабые в известной степени условно, поскольку в очень' разбавленных растворах электролиты диссоциированы практически полностью.
2. Электролит считается сильным, если степень диссоциации имеет значение больше 30%, а К > 10^2.
3. Для количественного описания диссоциации слабых электролитов применяют две характеристики: степень диссоциации и константу диссоциации.
4. Сильные электролиты закону действующих масс не подчиняются, константа диссоциации для них не определяется.
10. В случае диссоциации электролитов с многовалентными ионами, диссоциация происходит по ступеням, причём для каждой ступени существует собственное значение константы диссоциации.
Пример: Диссоциация многоосновной (борной) кислоты:
I стадия: H3BO3 ↔ H+ + H2BO3-,
II стадия: H2BO3- ↔ H+ + HBO32-,
III стадия: HBO32- ↔ H+ + BO33-,
Исходя из определения степени диссоциации, для электролита КА в реакции диссоциации [A-] = [K+] = α·c, [KA] = c — α·c = c·(1 — α), где α — степень диссоциации электролита.
Тогда:
![]()
Это выражение называют законом разбавления Оствальда. При очень малых α (α<<1) K=cα² и
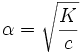
таким образом, при увеличении концентрации электролита степень диссоциации уменьшается, при уменьшении — возрастает. Подробнее связь константы диссоциации и степени диссоциации описана в статье Закон разбавления Оствальда.
Имеются электролиты, которые при диссоциации одновременно образуют катионы водорода, и гидроксид-ионы. Эти электролиты называются амфотерными или амфолитами. К ним относятся вода, гидроксиды цинка, алюминия, хрома и ряд других веществ. Вода, например, диссоциирует на ионы Н+ и ОН- (в незначительных количествах):
Н2O <-> Н+ + ОН-
Следовательно, у нее в равной мере выражены и кислотные свойства, обусловленные наличием катионов водорода Н+, и щелочные свойства, обусловленные наличием ионов ОН-.
Диссоциацию амфотерного гидроксида цинка Zn(ОН)2 можно выразить уравнением
2ОН- + Zn2+ + 2Н2О <-> Zn(ОН)2 + 2Н2О [Zn(ОН)4]2-+ 2Н+
11. СН3СООН<->Н++СН3СОO-
На степень диссоциации слабых электролитов влияет и добавление одноименных ионов. Так, введение в равновесную стему несильного электролита увеличивает концентрацию ионов, что в соответствии с принципом Ле Шателье приводит значительному сдвигу равновесия диссоциации влево, т. е. уменьшению степени диссоциации. Таким образом, добавление к раствору слабого электролита одноименных ионов уменьшает степень его диссоциации.
12. Оствальда закон разбавления, соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
![]()
Здесь К — константа диссоциации электролита, с — концентрация, l и l¥ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием действующих масс закона и равенства l/l¥ = a, где a — степень диссоциации. О. з. р. выведен В. Оствальдом в 1888 и им же подтвержден опытным путём. Экспериментальное установление правильности О. з. р. имело большое значение для обоснования теории электролитической диссоциации.
13. Активность (ионов) — эффективная концентрация с учетом электростатического взаимодействия между ионами в растворе. Активность отличается от концентрации на некоторую величину. Отношение активности (а) к концентрации вещества в растворе (с, в г-ион/л) называется коэффициентом активности: γ = a/c.
Активность ионов — эффективная (кажущаяся) концентрация ионов с учетом электростатического взаимодействия между ними в растворе. Активность отличается от общей концентрации на некоторую величину. Отношение активности (a) к общей концентрации вещества в растворе (c, в моль/л), то есть активность ионов при концентрации 1 моль/л, называется коэффициентом активности.
Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом:
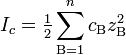
где cB — молярные концентрации отдельных ионов (моль/л), zB заряды ионов.
Например, для раствора NaCl с концентрацией 0,001 моль/л, в котором присутствуют два вида однозарядных ионов Na+ и Cl- с концентрациями также равными 0,001 моль/л, ионная сила будет вычисляться следующим образом:
I(NaCl) = 0,5(z2(Na+)•c(Na+) + z2(Cl-)•c(Cl-) ) = 0,5(12•c(NaCl) + (-1)2•c(NaCl) ) = c(NaCl)
И ионная сила соответственно будет равна концентрации раствора:
I = 0.5(12•0,001 моль/л + (-1)2•0,001 моль/л) = 0.5(0,001 моль/л + 0,001 моль/л) = 0,001 моль/л
Это верно для раствора любого сильного электролита, состоящего из однозарядных ионов. Для электролитов, в которых присутствуют многозарядные ионы, ионная сила обычно превышает молярность раствора.
Ионная сила раствора имеет большое значение в теории сильных электролитов Дебая — Хюккеля. Основное уравнение этой теории (предельный закон Дебая — Хюккеля) показывает связь между коэффициентом активности иона ze и ионной силы раствора I в виде:
![]()
где γ - коэффициент активности, А - постоянная, не зависящая от заряда иона и ионной силы раствора, но зависящая от диэлектрической постоянной растворителя и температуры.
14. Ионное произведение воды. Константа
воды
![]() Эту константу для воды называют ионным
произведением воды. Ионное произведение
воды зависит только от температуры; при
повышении температуры оно увеличивается.
Эту константу для воды называют ионным
произведением воды. Ионное произведение
воды зависит только от температуры; при
повышении температуры оно увеличивается.
При диссоциации воды (см. уравнение
выше) на каждый ион Н+ образуется один
ион ОН- , следовательно, в чистой воде
концентрации этих ионов должны быть
одинаковы: [H+] = [ОН- ].
Используя значение ионного
произведения воды, находим:![]()
акова концентрация ионов Н+ и ОН- в чистой воде. Рассмотрим, как изменится концентрация при добавлении других веществ, например соляной кислоты. Соляная кислота — сильный электролит, диссоциирующий в воде на ионы H+ и Cl- . Следовательно, концентрация ионов Н+ в растворе будет увеличиваться. Однако ионное произведение воды от концентрации не зависит, поэтому при увеличении [Н+] должна уменьшаться [ОН- ].
Напротив, если к воде добавить щелочь, то концентрация [ОН- ] увеличится, а [Н+] уменьшится. Таким образом, концентрации [Н+] и [ОН- ] взаимосвязаны: чем больше одна величина, тем меньше другая, и наоборот.
Кислотность растворов обычно выражают через концентрацию ионов Н+. В кислых растворах [Н+]>10-7 моль/л, в нейтральных [Н+] = 10-7 моль/л, в щелочных [Н+]< 10-7 моль/л.
рН раствора. Чтобы не писать числа с показателем степени, кислотность раствора часто выражают через отрицательный логарифм концентрации ионов водорода, называя эту величину водородным показателем и обозначая ее рН:
![]()
В кислых растворах рН < 7, в нейтральных рН = 7, в щелочных рН > 7.
15. Водоро́дный показа́тель, pH (произносится «пэ аш»), — это мера активности (в случае разбавленных растворов отражает концентрацию) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр:
Гидроксильный показатель рОН равен отрицательному десятичному логарифму концентрации ионов гидроксила: рОН = - lg[OH-]
16. Для определения значения pH растворов широко используют несколько методик. Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.
1. Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы — органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах — либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1—2 единицы.
Для расширения рабочего интервала измерения pH используют так называемый универсальный индикатор, представляющий собой смесь из нескольких индикаторов. Универсальный индикатор последовательно меняет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислой области в щелочную. Определения pH индикаторным методом затруднено для мутных или окрашенных растворов.
Использование специального прибора — pH-метра — позволяет измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH), чем с помощью индикаторов. Ионометрический метод определения pH основывается на измерении милливольтметром-ионометром ЭДС гальванической цепи, включающей специальный стеклянный электрод, потенциал которого зависит от концентрации ионов H+ в окружающем растворе. Способ отличается удобством и высокой точностью, особенно после калибровки индикаторного электрода в избранном диапазоне рН, позволяет измерять pH непрозрачных и цветных растворов и потому широко используется.
Аналитический объёмный метод — кислотно-основное титрование — также даёт точные результаты определения кислотности растворов. Раствор известной концентрации (титрант) по каплям добавляется к исследуемому раствору. При их смешивании протекает химическая реакции. Точка эквивалентности — момент, когда титранта точно хватает, чтобы полностью завершить реакцию, — фиксируется с помощью индикатора. Далее, зная концентрацию и объём добавленного раствора титранта, вычисляется кислотность раствора.
Влияние температуры на значения pH
0.001 мол/Л HCl при 20 °C имеет pH=3, при 30 °C pH=3
0.001 мол/Л NaOH при 20 °C имеет pH=11.73, при 30 °C pH=10.83
Влияние температуры на значения pH объяснятеся различной диссоциацией ионов водорода (H+) и не является ошибкой эксперимента. Температурный эффект невозможно компенсировать за счет электроники pH-метра.
17. Буферные растворы (англ. buffer, от buff — смягчать удар) — растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты и её соли (напр., СН3СООН и CH3COONa) или слабого основания и его соли (напр., NН3 и NH4CI). Величина рН буферного раствора мало изменяется при добавлении небольших количеств свободной сильной кислоты или щелочи, при разбавлении или концентрировании. Буферные растворы широко используют в различных химических исследованиях. Буферные растворы имеют большое значение для протекания процессов в живых организмах. Например, в крови постоянство водородного показателя рН поддерживается буферными смесями, состоящими из карбонатов и фосфатов. Известно большое число буферных растворов (ацетатно-аммиачный буферный раствор, фосфатный буферный раствор, боратный буферный раствор, формиатный буферный раствор и др.).
Буферные растворы сохраняют свое буферное действие до определенного предела, т. е. они обладают определенной буферной емкостью. Если ионов H+ или OH- оказалось в растворе больше, чем позволяет буферная емкость раствора, то pH будет изменяться в значительной степени, как и в небуферном растворе.
Обычно в методиках анализа указывается, каким именно буферным раствором следует пользоваться при выполнении данного анализа и как его следует приготовить.
Для настройки pH-метров применяют стандартные буферные растворы с точными значениями pH.
Принятая в России по стандарту 8.134-74 шкала pH основана на воспроизводимых значениях pH нескольких растворов. Шкала pH обладает внутренней согласованностью, т.е. экспериментально измеренная величина pH не зависит от того, какой из растворов был выбран в качестве стандартного.
Буферная ёмкость раствора (от англ. buffer — амортизатор, англ. buff — смягчать толчки) — определяет способность раствора сохранять постоянной концентрацию определённых ионов (обычно применяется к ионам H+) при условии, что в растворе протекают химические реакции, или при добавлении к раствору электролитов.
Для реакций, скорости которых пропорциональны концентрации соответствующих ионов, это означает поддержание постоянных условий проведения реакции.
