
- •Ступінь електролітичної дисоціації
- •Іонний добуток води
- •Добуток розчинності
- •50. Іонні реакції — реакції між іонами в розчині. Наприклад, реакцію
- •52Електрохімі́чний ряд напру́г, ряд активності — послідовність металів за ступенем легкості віддачі електронів при хімічних реакціях у водних розчинах солей.
- •Періодична система
- •Хімічні властивості
- •Хімічні властивості
- •1. Механізм металевої зв'язку
- •Одержання металів з руд
- •Хімічні властивості
- •Способи усунення твердості води
- •Хімічні властивості
1. Механізм металевої зв'язку
У всіх вузлах кристалічної решітки розташовані позитивні іони металу. Між ними безладно, подібно молекулам газу, рухаються валентні електрони, відчепили від атомів при утворенні іонів. Ці електрони відіграють роль цементу, утримуючи разом позитивні іони, інакше грати розпалася б під дією сил відштовхування між іонами. Разом з тим і електрони утримуються іонами в межах кристалічної решітки і не можуть її покинути. Сили зв'язку не локалізовані і не спрямовані. Тому в більшості випадків виявляються високі координаційні числа (наприклад, 12 або 8).
Хімічний зв'язок |
|||||||
Внутримолекулярное взаємодія |
|
||||||
Міжмолекулярна взаємодія |
|
||||||
68
Одержання металів з руд
В більшості випадків руди містять різні домішки у вигляді піску, глини, вапняку тощо. Ці домішки називають пустою породою. Коли в руді багато пустої породи, тобто коли руда є бідною на корисну речовину, таку руду піддають збагаченню, тобто видаляють з неї частину пустої породи. Різні руди збагачують різними способами.
Для збагачення сульфідних руд звичайно застосовують спосіб флотації (спливання). При цьому способі руду розмелюють у тонкий порошок і заливають у великих чанах водою. До води додають певні органічні речовини (наприклад, соснове масло, вищі жирні кислоти тощо), молекули яких добре адсорбуються частинками сульфідів, і вкривають їх тонкою плівкою, внаслідок чого вони не змочуються водою. Крізь воду продувають повітря, пухирці якого з маслом утворюють піну, а також прилипають до частинок сульфідів, і вони спливають та збираються зверху разом з піною, а змочені водою частинки пустої породи осідають на дно (див. мал. Схема флотаційного апарату).Піну з сульфідами металів зливають з чану і віджимають сульфіди. Так одержують збагачену на корисну речовину руду.
Вільні метали добувають з руд різними способами. З оксидних руд метали одержують відновленням їх при високих температурах. При цьому як відновник частіше всього використовують вугілля (кокс) і монооксид вуглецю СО. Наприклад:
Fe2O3 + 3C = 2Fe + 3CO ↑
Fe2O3 + 3CO = 2Fe + 3CO2 ↑
SnO2 + C = Sn + CO2 ↑
2Cu2O + C = 4Cu + CO2 ↑
Інколи відновником служать активні метали. Наприклад, при добуванні хрому, берилію, мангану і ін. як відновник застосовують алюміній (алюмінотермія):
Cr2O3 + 2Al = 2Cr + Al2O3
3MnO2 + 4Al = 3Mn + 2Al2O3
У деяких випадках як відновник використовують водень, зокрема при добуванні молібдену, вольфраму, порошкоподібного заліза тощо:
Fe2O3 + 3H2 = 2Fe + 3H2O
WO3 + 3H2 = W + 3H2O
Сульфідні руди спочатку обпалюють, переводячи їх в оксиди металів, які потім відновлюють. Наприклад:
2PbS + 3O2 = 2PbO + 2SO2 ↑
PbO + C = Pb + CO ↑
Найактивніші метали — калій, натрій, кальцій і ін. — не можна одержати способом хімічного відновлення їх сполук. Ці метали одержують лише електролізом їх розплавлених солей. Наприклад:
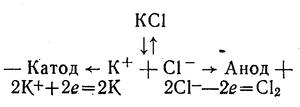
Карботермі́я (від лат. carbo (carbonis) – вугілля і грец. therme — теплота, жар) — металургійні процеси, засновані на відновленні металів з їх з'єднань вуглецем іматеріалами, що містять вуглець, при підвищених температурах.
Найпоширеніший матеріал, що містить вуглець, — металургійний кокс.
Розрізняють пряме відновлення (твердим вуглецем) і непряме (окислом вуглецю). Карботермічне відновлення лежить воснові металургії заліза (Доменне виробництво). Укольоровій металургії з допомогою карботермії отримують свинець, олово, значну частину цинку і деякі інші метали.
Металотермі́я (від метали і грец. thérme — теплота) — процеси, засновані на відновленні металів з їхніх з'єднань (оксидів, галлоїдів і інші) активнішими металами (алюмінієм, магнієм, кремнієм, що умовно приймається за метал, і інші), які протікають з виділенням теплоти. Металотермія почала застосовуватися на рубежі 19—20 століття Металотермічні процеси класифікують за металом-відновником: алюмінотермічні (Алюмінотермія), магнієтермічні, силікотермічні (Силікотермія). Металотермічні способи виробництва дорожчі, ніж вуглевідновлення (Карботермія), і використовуються для отримання безвуглецевих легуючих сплавів високої якості (лігатури з рідкісними металами, безвуглецевий ферохром і ін.), титанової губки і інших чистих (головним чином по вуглецю) металів і сплавів.
Існує декілька різновидів металотермічного процесу. Позапічний процес проводиться в тих випадках, коли теплоти, що виділяється під час протікання відновних реакцій, досить для отримання продуктів реакції в рідкому стані і хорошого їхнього розділення (1750—2300 °С); використовується в алюмінотермії. Електропічний процес застосовується, коли теплоти, що виділяється, недостатньо для розплавлення і необхідного перегріву продуктів плавки — тепло, що не вистачає, підводиться за допомогою електронагріву; процес широко поширений. Вакуумна металотермія дозволяє виділяти метали, що легко випаровуються (наприклад, магній) під час їх відновлення в умовах вакууму (при 800—1 400 °С) або отримувати метали з пониженим вмістом газів.
71
Лу́жні мета́ли — елементи групи 1 періодичної системи, за старою класифікацією головної підгрупи I групи. Назва пов'язана з тим, що при взаємодії лужних металів з водою утворюється їдкий луг. До лужних металів належать (у порядку збільшення атомного номера) літій (Lі), натрій (Na), калій (K), рубідій (Rb), цезій (Cs) , францій (Fr).
