
- •Ступінь електролітичної дисоціації
- •Іонний добуток води
- •Добуток розчинності
- •50. Іонні реакції — реакції між іонами в розчині. Наприклад, реакцію
- •52Електрохімі́чний ряд напру́г, ряд активності — послідовність металів за ступенем легкості віддачі електронів при хімічних реакціях у водних розчинах солей.
- •Періодична система
- •Хімічні властивості
- •Хімічні властивості
- •1. Механізм металевої зв'язку
- •Одержання металів з руд
- •Хімічні властивості
- •Способи усунення твердості води
- •Хімічні властивості
1. Хімія - наука про хімічні елементи, їх з'єднання і перетворення, що відбуваються в результаті хімічних реакцій. Вона вивчає, з яких речовин складається той або інший предмет; чому і як іржавіє залізо, і чому олово не іржавіє; що відбувається з їжею в організмі; чому розчин солі проводить електричний струм, а розчин цукру — ні; чому одні хімічні зміни відбуваються швидко, а інші — повільно. 1.1 Фізичні явища не супроводжуються утворенням нових речовин. Вони виявляються у зміні форми тіла або агрегатного стану речовини. Суть хімічних явищ полягає у перетворенні речовин, яке супроводжується утворенням однієї або кількох нових речовин. Хімічне явище і є хімічною реакцією. Ознаками хімічних реакцій можуть бути виділення газу, утворення або зникнення осаду, зміна забарвлення, поява або зникнення запаху, виділення або поглинання теплоти, випромінювання світла тощо. Для виникнення і перебігу хімічної реакції необхідно подрібнення і перемішування речовин, а часто й нагрівання їх до певної температури.
2. Атомно-молекулярне вчення — уявлення про існування двох видів найдрібніших частинок речовини — молекул і атомів.
Основні положення якого були розроблені в середині XVIII ст. М.В.Ломоносовим і Дж. Дальтоном. Суть теорії полягає в тому, що всі речовини складаються з надзвичайно дрібних невідчутних частинок — молекул. Молекули перебувають у безперервному русі.
Швидкість руху молекул залежить від природи і фізичного стану речовини. З найбільшою швидкістю рухаються молекули газів, значно повільніше — молекули рідин, найповільніше — молекули твердих речовин. Молекули, в свою чергу, складаються з ще дрібніших частинок — «елементів» (атомів). Атоми бувають різних видів. Якщо молекули складаються з атомів одного виду, то вони утворюють прості речовини, а коли з атомів різних видів, то складні речовини.
Атомно-молекулярне вчення остаточно було запроваджене, в хімію лише на початку другої половини XIX ст. і тепер становить теоретичну основу хімії.
Сучасна хімія теж розрізняє два види найдрібніших частинок речовини — молекули і атоми. Молекули — це найменші частинки речовини, які можуть самостійно існувати і мають такий самий хімічний склад і хімічні властивості, як і речовина. Усі молекули даної речовини однакові і відрізняються від молекул інших речовин своєю масою, розмірами, будовою і хімічними властивостями.
Під час фізичних явищ молекули залишаються незмінними. У процесі ж хімічних реакцій молекули даної речовини руйнуються і речовина перетворюється в іншу речовину з новими молекулами і новими властивостями.
Молекули всіх речовин, у свою чергу, складаються з атомів. Атоми є хімічно неподільними частинками. Це означає, що при всіх хімічних перетвореннях речовин атоми не руйнуються і не утворюються. Загальна кількість атомів під час хімічних реакцій залишається незмінною. Атоми тільки перегруповуються, утворюючи молекули нових речовин.
3. З точки зору атомно-молекулярного вчення закон збереження маси речовин пояснюється тим, що під час хімічних реакцій загальна кількість атомів окремих елементів залишається незмінною, бо при хімічних перетвореннях речовин атоми не зникають безслідно і не утворюються з нічого, а тільки перегруповуються з молекул одних речовин у молекули інших речовин. Цей закон є основним для хімії і всього природознавства. Йому підлягають всі хімічні перетворення, що відбуваються в природі і техніці. На ньому основуються також усі розрахунки в хімії.
Закон збереження енергії (англ. energy conservation law;) - закон, який стверджує, що повна енергія в ізольованих системах не змінюється зчасом. Проте енергія може перетворюватися з одного виду в інший. Утермодинаміці закон збереження енергії відомий також під назвою першого закону термодинаміки. Закон збереження енергії є, мабуть, найважливішим із законів збереження, які застосовуються в фізиці.
Визначальним моментом для встановлення закону збереження енергії стало встановлення еквівалентності між теплом, кількісною характеристикою якого є кількість теплоти, і механічною роботою. Якщо тілу надати певну кількість теплоти Q, то частина її піде на виконання механічної роботи A, а частина на збільшення внутрішньої енергії тіла:
![]() ,
,
4. Прості́ речови́ни (рос. вещества простые, англ. elementary substances,нім. einfache Stoffe m pl) — речовини, молекули яких складаються з атоміводного і того самого хімічного елементу. Наприклад, до простих речовин належать водень, азот, хлор та інші, бо молекули водню H2 складаються тільки з атомів водню (гідрогену), молекули азоту N2 — тільки з атомів азоту (нітрогену), молекули хлору Cl2 — тільки з атомів хлору. Молекули деяких простих речовин складаються тільки з одного атома. Наприклад, молекулигелію і аргону складаються з одного атома гелію — He і аргону — Ar. Молекули всіх інших інертних газів теж складаються з одного атома.
Хімі́чний елеме́нт — тип (вид, сорт) атомів з однаковим зарядом атомних ядер (тобто однаковою кількістю протонів в ядрі атому) і певною сукупністю властивостей. Маса ядра атома хімічного елементу може бути різною, в залежності від кількості нейтронів у ньому. Сукупність атомів елементу з однаковою масою називається нуклідом, а ізотопами називаються атоми одного елементу з різними масами. Атоми даного хімічного елементу відрізняються від атомів інших елементів величиною заряду ядра, кількістю та характером розміщення електронів навколо ядра, розмірами і хімічними властивостями. У нейтрального атома число електронів на електронних оболонках дорівнює заряду ядра. У разі, коли кількість електронів не збігається з кількістю протонів у ядрі, уворюється іон, однак це іон відповідного хімічного елемента.
Алотропія (від гр. ἄλλος, állos — інший і τρόπος, trópos — властивість) — явище, коли хімічний елемент існує у вигляді двох або кількох простих речовин. Так проста речовина кисень O2 і проста речовина озон O3 є алотропічними видозмінами елементу оксигену.
5. Зако́н ста́лості скла́ду (рос. закон постоянства состава, англ. law of constant proportions) був відкритий французьким вченим Жозефом Прустому 1799 році. Він формулюється так: кожна хімічна сполука завжди має один і той самий склад.
Це пояснюється тим, що молекули кожної речовини завжди містять одну й ту ж кількість атомів тих самих елементів. Так, молекули води H2O завжди складаються з двох атомів Гідрогену і одного атома Оксигену, молекулисульфіду заліза FeS — з одного атома Феруму і одного атома Сульфуруі т. д. Коли б до складу молекул цих речовин входили атоми іншихелементів або атоми тих самих елементів, але в іншій кількості, то ці речовини — і вода, і сульфід заліза — були б іншими речовинами.
Звідси випливає дуже важливий висновок: хімічний склад даної речовини не залежить від часу, місця і способу її одержання.
На основі закону сталості складу хімічних сполук можна позначити склад їх молекул за допомогою хімічних формул.
Сталістю свого складу хімічні сполуки відрізняються від механічних сумішей, склад яких може змінюватись у будь-яких співвідношеннях.
Закон об'ємних відношень, за яким при постійних температурі і тиску об'єми газів, які вступають у реакцію, відносяться між собою і до об'ємів газоподібних продуктів реакції, як невеликі прості числа. Наприклад, при взаємодії одного об'єму водню з одним об'ємом хлору утворюється два об'єми хлористого водню.
Закон кратних відношень (рос. закон кратных отношений; англ. law of multiple proportions; нім. Gesetz n der multiplen Proportionen f pl) – якщо два елементи, що реагують між собою, утворюють декілька сполук, то різні масові кількості одного елемента, що сполучаються з однією і тією ж масовою кількістю другого, відносяться як невеликі цілі числа. Даний закон сформульовано в 1803 році Джоном Дальтоном. Відтак, елементи завше з'єднуються між собою в певних масових кількостях, що відповідають їх еквівалентам.
Цей закон стосується лише дальтонідів і його зручно проілюструвати на оксидах азоту N2O, NO, N2O3, N2O4, N2O5 масова кількість кисню, з'єднаного з однаковою масовою кількістю азоту, знаходяться у співвідношенні 1:2:3:4:5.
6. Закон еквівалентів — маси речовин, які вступають у реакцію та утворюються після неї, пропорційні їхнім еквівалентам.
![]()
Еквівалент (Е) — еквівалентом елемента називають таку його кількість, яка взаємодіє з 1 м.ч. Н або 8 м.ч. О або заміщує таку кількість хімічних реакцій.
Еквівалент - це частина атому,молекули або йону яка припадає на одну зміної валентності або ступеню окиснення. Наприклад, в сполуках HCl, H2S,NH3, CH4 еквівалент хлора, сірки, нітрогену, вуглеця дорівнює відповідно 1 моль, 1/2 моль, 1/3 моль, 1/4 моль.
Маса одного еквіваленту називається його еквівалентною масою.Так, в наведених вище прикладах еквівалентні маси хлору, сірки, нітрогену та вуглецю відповідно дорівнюють 34,45 г/моль, 32/2=16 г/моль, 14/3=4,67 г/моль, 12/4=3 г/моль.
7. Зако́н Авога́дро — однакові об'єми будь-яких газів при однаковому тиску і температурі містять однакову кількість молекул. Цей закон був відкритий італійським фізиком Амедео Авогадро в 1811 році.
Моль — одиниця кількості речовини в системі СІ. Позначається моль, Mol. Інша назва — грам-молекула.
Кількість
речовини, що містить число
Авогадро (![]() )
структурних формульних одиниць.
Формульні одиниці — реальні частки,
такі як атоми, молекули, іони, радикали.
)
структурних формульних одиниць.
Формульні одиниці — реальні частки,
такі як атоми, молекули, іони, радикали.
За формальним означенням моль — це кількість речовини, виражена вграмах, що чисельно дорівнює її молекулярній масі і відзначається тим, що одному молю будь-якої речовини відповідає однакова кількість молекул. А саме, 1 моль містить стільки молекул (атомів, йонів, інших структурних елементів речовини), скільки атомів у 0,012 кг вуглецю 12С, тобто дорівнює сталій Авоґадро. Позначення «Моль» введене у 1893 році Вільгельмом Оствальдом і походить від слова «молекула».
Молярна маса — маса 1 моля речовини, тобто такої кількості структурних одиниць цієї речовини (атомів чи молекул), що міститься в 0,012 кг вуглецю12С.
Зв'язок між молярною масою та атомною масою хімічного елемента - атомні маси, наведені в Періодичній системі елементів, можна інтерпретувати як масу одного атома в атомних одиницях маси (а. о. м.) або як молярну масу елемента в грамах (г/моль), тобто вони рівні чисельно, але мають різні розмірності. Молярна маса використовується в стехіометричних розрахунках.
Відносна молекулярна маса — це фізична величина, що дорівнює відношенню маси речовини певного формульного складу до 1/12 маси атома Карбону. Як зрозуміти вираз «формульний склад»? Це склад речовини, що визначається її формулою. Якщо є потреба визначити відносну молекулярну масу речовини, то зовсім не обов'язково ділити масу речовини певного формульного складу на 1/12 маси атома Карбону, як випливає із визначення. Достатньо просто додати відносні атомні маси елементів, які входять до формульного складу речовини, пам'ятаючи при цьому, що відносна молекулярна чи формульна маса — безрозмірна величина. Як це зробити практично? Розглянемо конкретні приклади. Передусім запам'ятай, що спочатку пишемо Мr, а після символу Мr у круглих дужках обов'язково зазначаємо формульний склад сполуки, відносна молекулярна або формульна маса якої обчислюється. Наприклад: Мr(N2) - 2Аr(N); Мr(N2) = 2 • 14 = 28; Мr(Н2S) = 2Аr(Н) + Аr(S); Мr(Н2S) = 2 • 1 + 32 = 34; Мr(Na2CO3) = 2Аr(Nа) + Аr(С) + 3Аr(O); Мr(Nа2СO3) = 2 • 23 + 12 + 3 • 16 = 106. Надалі, визначаючи відносні молекулярні чи формульні маси речовин, дотримуйся такого алгоритму дій: 1. За періодичною системою знайди символи хімічних елементів і запиши заокруглені значення їх відносних атомних мас. 2. Ці значення помнож на число атомів елемента (на індекс). 3. Додай маси атомів усіх елементів, і ти дістанеш відносну молекулярну (формульну) масу. Хімічна формула дає змогу обчислити не тільки відносну молекулярну чи формульну маси, а ще й масову частку, яка припадає на кожний елемент у складі речовини.
Атомна маса Кожен атом хімічного елемента має певну масу. В яких одиницях ця маса виражається? Якщо скористатися звичайними одиницями маси, наприклад грамами, то маса т найлегшого з хімічних елементів — атома Гідрогену становитиме 0, 000 000 000 000 000 000 000 001 67 г. Таке число важко прочитати і важко ним користуватися. Тому такі числа заведено записувати у так званому стандартному вигляді, а саме: m(Н) = 1,67 • 10-24. Найважчі атоми, які існують в природі на Землі, це атоми елемента Урану U. їхня маса дорівнює 0, 000 000 000 000 000 000 000 395 г.
8. Молярний об'єм — об'єм, що його займає 1 моль речовини.
Vν = V/ν,
де V - об'єм, ν - кількість речовини
Молярний об'єм ідеального газу (за нормальних умов (273,15 К, 101325 Па):
Vm = 22,41383(70)·10−3 м3/моль
Молярний об'єм газів залежить від тиску й температури. Зв'язок між цими величинами задається рівнянням стану.
У системі СІ молярний об'єм виражається в метрах кубічних на моль (м3/моль). У практичному використанні зручнішими одиницями є дециметри кубічні (літри) на моль (дм3/моль) для газів та сантиметри кубічні на моль для рідин та твердих тіл (см3/моль).
Відносна густина газу — величина, що показує, у скільки разів відносна молекулярна маса одного газу більша або менша від відносної молекулярної маси іншого газу, взятого для порівняння. D = Mr1/Mr2.
9. Рівняння Менделєєва — Клапейрона
Величини p, V і T,
які визначають стан газу, називають
параметрами стану. Рівняння, до складу
якого одночасно входять всі параметри,
називається рівнянням
стану.
Тиск p газу
залежить від значень T і V:![]() .
Перехід від пропорційності до рівняння
спочатку було здійснено за допомогою
коефіцієнта, який мав стале значення
(був константою) для даного газу, але
мав різні значення для інших газів (ця
константа не була універсальною). Таким
чином було одержано рівняння стану,
назване рівнянням Клапейрона:
.
Перехід від пропорційності до рівняння
спочатку було здійснено за допомогою
коефіцієнта, який мав стале значення
(був константою) для даного газу, але
мав різні значення для інших газів (ця
константа не була універсальною). Таким
чином було одержано рівняння стану,
назване рівнянням Клапейрона:
![]() .
Коефіцієнт
пропорційності став універсальним
завдяки Дмитру Менделєєву, який
запропонував розглядати різні гази в
однакових кількостях, тому рівняння
стало називатися рівнянням Менделєєва
— Клапейрона.
Для
1 моль газу ,
або .
Величина
.
Коефіцієнт
пропорційності став універсальним
завдяки Дмитру Менделєєву, який
запропонував розглядати різні гази в
однакових кількостях, тому рівняння
стало називатися рівнянням Менделєєва
— Клапейрона.
Для
1 моль газу ,
або .
Величина ![]() називається універсальною (або молярною) газовою
сталою.
Для n моль:.
називається універсальною (або молярною) газовою
сталою.
Для n моль:.
10. Закон Дюлонга-Пти (Закон постоянства теплоёмкости) — эмпирический закон, согласно которому молярная теплоёмкость твёрдых тел при комнатной температуре близка к 3R[1]:
где R — универсальная газовая постоянная.
Закон выводится в предположении, что кристаллическая решетка тела состоит из атомов, каждый из которых совершает гармонические колебания в трех направлениях, определяемыми структурой решетки, причем колебания по различным направлениям абсолютно независимы друг от друга. При этом получается, что каждый атом представляет три осциллятора с энергией E, определяемой следующей формулой:
Формула вытекает из теоремы о равнораспределении энергии по степеням свободы. Так как каждый осциллятор имеет одну степень свободы, то его средняя кинетическая энергия равна , а так как колебания происходят гармонически, то средняя потенциальная энергия равна средней кинетической, а полная энергия - соответственно их сумме. Число осцилляторов в одном моле вещества составляет , их суммарная энергия численно равна теплоемкости тела - отсюда и вытекает закон Дюлонга-Пти.
Приведем таблицу экспериментальных значений теплоемкости ряда химических элементов для нормальных температур:
-
Элемент
, кал/(К·моль)
Элемент
, кал/(К·моль)
C
1,44
Pt
6,11
B
2,44
Au
5,99
Al
5,51
Pb
5,94
Ca
5,60
U
6,47
Ag
6,11
-
-
Зависимость теплоёмкости от температуры при низких температурах объясняется в моделях Эйнштейна и Дебая.
11. Хімі́чна фо́рмула — скорочене позначення складу молекул речовини за допомогою хімічних символів.
Оскільки усі молекули даної речовини мають однаковий склад, то хімічна формула одночасно показує і склад речовини. При складанні формули даної речовини треба написати в ряд символи хімічних елементів, що входять до складу цієї речовини, і справа кожного з них внизу маленькою цифрою (індексом) позначити кількість атомів кожного елементу.
Хімічна формула показує, назву речовини, молекулу цієї речовини, з яких елементів складається дана речовина, скільки атомів кожного елементу входить до складу молекули цієї речовини, молекулярну масу речовини.
Наприклад, формула H3PO4 показує, що це фосфатна кислота, що взята одна молекула цієї кислоти, що до її складу входять водень, фосфор і кисень, що молекула її складається з трьох атомів водню, одного атома фосфору і чотирьох атомів кисню, що молекулярна маса її дорівнює 98.
Масова частка елемента в речовині — це фізична величина, що визначається відношенням маси, яка припадає на елемент, до маси всієї речовини. Масова частка позначається W (читається дубль-ве) і виражається у частках одиниці або у відсотках. Спосіб обчислення полягає у знаходженні частини від цілого за формулою: W = nAr / Mr де W — масова частка елемента; Аr — відносна атомна маса елемента; n — кількість атомів елемента у формулі; Мr — відносна молекулярна або формульна маса речовини. Приклад. Обчисли масову частку Алюмінію у глиноземі Аl2О3. Розв' язання. Дано: Аl2O3 W(Al) = ? Мr(Аl2О3) = 2Аr(Аl) + ЗАr(O); Мr(Аl2О3) = 2 • 27 + 3 • 16 = 102; W(Al) = 54/102 = 0,53, або 53 % Відповідь. Масова частка Алюмінію в глиноземі становить 53 %. Знаючи масову частку елемента в речовині, можна знайти і масу елемента, який у вигляді простої речовини можна добути з будь-якої маси речовини. Приклад. Визнач, яку масу алюмінію можна дістати з глинозему масою 200 тис. т, якщо відомо, що масова частка Алюмінію в глиноземі становить 53 %. Розв' язання. Дано: m(Аl2O3) = 200 тис. т W(Аl) = 53 % = 0,53 m(Аl) — ? З умови задачі відомо, що глинозем масою 1 т містить 1 т • 0,53 = 0,53 т Аl, а 200 тис. т — 200 тис. т • 0,53 = 106 тис. т Аl. Відповідь. З глинозему Аl2О3 масою 200 тис. т можна дістати алюміній масою 106 тис. т. Якщо треба обчислити ще й масову частку Оксигену в глиноземі, то: W(O) = 100 % - 53 % = 47 %, або W(О) = 48/102 = 0,47 = 47 %. Зрозуміло, що сума масових часток усіх елементів у сполуці дорівнює 1, або 100 %. Це потрібно брати до уваги під час перевірки правильності обчислень. Варто звернути увагу на обернену задачу. Адже, знаючи масові частки елементів, можна знайти хімічну формулуречовини. Приклад. Виведи формулу речовини, якщо відомо, що до її складу входить Сульфур (масова частка становить 40 %) і Оксиген. Розв'язання. Дано: W(S) = 40 % W(О) = 60 % SxOy - ? Позначимо число атомів Сульфуру через х, атомів Оксигену — через у. Число атомів у речовині прямо пропорційне масовій частці елемента й обернено пропорційне його відносній атомній масі, тобто
![]() Знайдені
числа виражають кількісне відношення
між атомами елементів. Але відношення
між атомами може бути виражене тільки
цілими числами. Тому обираємо найменше
із знайдених чисел, приймаємо його за
одиницю і ділимо на нього решту чисел:
Знайдені
числа виражають кількісне відношення
між атомами елементів. Але відношення
між атомами може бути виражене тільки
цілими числами. Тому обираємо найменше
із знайдених чисел, приймаємо його за
одиницю і ділимо на нього решту чисел:
![]() Відповідь.
Формула речовини SO3.
Відповідь.
Формула речовини SO3.
12. Класи неорганічних сполук:
оксиди
основи
кислоти
солі
13. КИСЛОТНІ ОКСИДИ.
ОСНОВНІ ОКСИДИ.
НЕСОЛЕТВОРНІ ОКСИДИ.
Оксиди активних металів взаємодіють з водою, утворюючи розчинні гідроксиди металів, або основи. Оксиди металів, яким відповідають основи, називаються основними оксидами. Оксиди неметалів взаємодіють з водою, утворюючи розчинні кислоти. Оксиди неметалів, яким відповідають кислоти, називаються кислотними оксидами. Кислотним і основним оксидам, що не розчиняються у воді, відповідають нерозчинні кислоти й нерозчинні основи. Кислотні й основні оксиди — солетворні.
Добування оксидів. Оксиди можна добути різними способами. Головними є три.
Безпосереднє сполучення простої речовини — металу або неметалу — з киснем за різних умов: 2Mg + O2 = 2MgO С + O2 = СO2
Горіння складних речовин: СН4 + 2O2 = СO2 + 2Н2O
Розкладання під час нагрівання кисневих сполук (гідроксидів, карбонатів тощо): Cu(OH)2 = CuO + H2O H2SO4 = SO3 + H2O CaCO3 = CaO + CO2
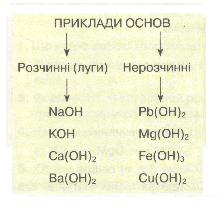
14. Класифікація основ. За розчинністю у воді основи поділяють на:
а) розчинні, або луги, — NaOH, КОН, Са(ОН)2, Ва(ОН)2 тощо;
б) нерозчинні —
купрум(ІІ) гідроксид Си(ОН)2,
ферум(ІІІ) гідроксид Fe(OH)3 та
ін.
Основи мають немолекулярну будову. Завдяки наявності гідроксильної групи в їхньому складі, водні розчини основ (луги) мають спільні властивості — змінюють колір індикаторів: лакмус у лужному середовищі синіє, фенолфталеїн набуває малинового забарвлення, а метилоранж — жовтого. Нерозчинні основи на індикатори не діють. Спільною властивістю для всіх основ (і розчинних, і нерозчинних) е здатність взаємодіяти з кислотами, тобто вступати в реакцію нейтралізації, утворюючи сіль і воду. Розчинні основи — луги — взаємодіють з кислотними оксидами (оксидами неметалів), утворюючи сіль тієї кислоти, що відповідає взятому оксиду, і воду. Нерозчинні основи, на відміну від лугів, розкладаються під час нагрівання на основний оксид і воду.
15. Кислоти — складні речовини, що містять у своєму складі Гідроген, здатний заміщуватися на метал, і кислотний залишок. За складом кислоти бувають оксигеновмісні та безоксигенові, а за основністю — одно-, двох-, три- і багатоосновні. Основність кислоти визначається числом атомів Гідрогену, які заміщуються металом. Від основності кислоти залежить валентність кислотного залишку — атома або групи атомів, що під час хімічної реакції переходить без змін з молекули кислоти до іншої сполуки.
Добування кислот
Багато оксигеновмісних кислот можна добути взаємодією кислотних оксидів з водою, наприклад: SO3 + Н2O = H2SO4 N2O5 + Н2O = 2HNO3 Але ти пам'ятаєш, що не всі кислоти можна добути, розчинюючи відповідний оксид у воді. Так, силіцій(IV) оксид SiO2 — складова річкового піску — у воді не розчиняється. Проте і йому відповідає певна кислота — силікатна H2SiO3, тільки добувають її не з оксиду, а іншим способом: Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓ Безкисневі кислоти НСl, HBr, HI, H2S добувають синтезом з водню та неметалу й наступним розчиненням водневої сполуки у воді: Н2 + Сl2 = 2НСl
16. Солі мають немолекулярну будову. Це — продукти заміщення атомів Гідрогену в кислоті на атоми металу. Вони являють собою складні речовини, що містять атоми металу й кислотні залишки. Назви солей утворюються від назв відповідних кислот. Солі поділяють на середні (продукти повного заміщення Гідрогену кислоти на метал) і кислі (продукти неповного заміщення Гідрогену кислоти на метал).
Хімічні властивості солей визначаються їх відношенням до кислот, основ, металів і інших солей. 1. Солі можуть взаємодіяти з кислотами лише в тому випадку, коли реагуюча кислота сильніша за ту, від якої походить дана сіль. Наприклад:
* FeS + 2HCl = FeCl2 + H2S u93; * Na2SiO3 + Н2SO4 = Na2SO4 + H2SiO3 u95;
2. Солі можуть взаємодіяти з лугами, коли внаслідок реакції утворюється нерозчинна основа або нерозчинна сіль. Наприклад:
* FeCl3 + 3NaOH = 2NaCl + Fe(OH)3 u95; * K2CO3 + Ba(OH)2 = 2KOH + BaCO3 u95;
3. Розчини солей можуть взаємодіяти з металами, коли даний метал в електрохімічному ряду напруги стоїть лівіше від металу солі. Наприклад:
* CuSO4 + Fe = FeSO4 + Cu * HgCl2 + Cu = CuCl2 + Hg
4. Багато солей у розчинах можуть взаємодіяти одна з одною, коли одна із солей, що утворюється внаслідок реакції, є нерозчинною. Наприклад:
* Na2CO3 + CaCl2 = 2NaCl + CaCO3 u95; * FeSO4 + BaCl2 = FeCl2 + BaSO4 u95;
Найважливіші способи добування солей:
1Реакція нейтралізації: КОН + HNО3 = KNО3 + Н2О
2Взаємодія кислот з основними оксидами: CuO + H2SО4 = CuSO4 + Н2О
3Взаємодія кислот із солями: ВаСl2 + H2S04 = BaS04↓ + 2НСl
4Взаємодія кислот з металами: Mg + 2HCl = MgCl2 + H2↑
5Взаємодія двох різних солей: AgNО3 + КСl = AgCl↓ + KNО3
6Взаємодія солей з металами: Fe + CuSO4 = FeSО4 + Cu
7Взаємодія солей з лугами: ЗКОН + FeCl3 = Fe(OH)3↓ + ЗКСl
8Взаємодія лугів з кислотними оксидами: Са(ОН)2 + СО2 = СаСО3 + Н2О
9Взаємодія основних оксидів з кислотними: СаО + SiО2 = CaSiО3
10Взаємодія металів із неметалами: Fe + S = FeS
17. Хімічні реакції класифікуються за такими ознаками: 1) зміна або відсутність зміни кількості реагентів і продуктів реакції. За цією ознакою реакції поділяються на чотири основних типи:
реакції сполучення — реакція, під час якої з двох або кількох речовин утворюється одна нова речовина.
реакції розкладу — реакція, під час якої з однієї речовини утворюється дві або кілька нових речовин.
реакції заміщення — реакція між простою і складною речовинами, у процесі якої атоми простої речовини заміщують атоми одного з елементів у складній речовині, внаслідок чого утворюються нова проста і нова складна речовини.
-реакції обміну — реакція, у процесі якої дві складні речовини обмінюються своїми складовими частинами.
Такий розподіл, або класифікація, реакцій на окремі групи полегшує їх вивчення, оскільки реакції тієї чи іншої групи чи типу мають ряд спільних ознак. Більшість хімічних реакцій, що відбуваються в природі і техніці, являють собою досить складний комплекс різнотипних реакцій.
Реакцiя |
Загальна схема |
Приклади |
Сполучення |
A + B → AB |
C + O2 → CO2 |
CaO + CO2 → CaCO3 |
||
C2H4 + HBr → C2H5Br |
||
CO2 (г) + H2O (р) → H2CO3 (aq) |
||
H2CO3 (aq) + BaCO3 (тв) → T ≈ 298 K, P ≈ 100 кПа Ba(HCO3)2 (aq) |
||
CaO (тв) + H2O (р) → T = 298,15 K, P = 101,325 кПа Ca(OH)2 (тв) & ΔH = −63,7 кДж / (моль CaO) |
||
Розкладу |
AB → A + B |
2 H2O → 2 H2 + O2 |
C2H5Br → C2H4 + HBr |
||
ZnCO3 (тв) → T >> 373 K, P ≈ 100 кПа ZnO (тв) + CO2 (г) |
||
Замiщення |
A + BC → B + AC |
Zn + CuSO4 → Cu + ZnSO4 |
2 Al + 6 HCl → 2 AlCl3 + 3 H2 ↑ |
||
O2 (г) + HgS (тв) → Hg (г) + SO2 (г) |
||
C (тв) + ZnO (тв) → T > 1223 K, P ≈ 100 кПа Zn(г) + CO (г) |
||
C (тв) + H2O (г) → T ≥ 1273 K, P ≈ 101 кПа H2 (г)+ CO (г) & ΔH ≈ +120 кДж / моль |
||
Обмiну |
AB + CD → AD + CB |
C2H5OH + HONO2 → C2H5ONO2 + H2O |
BaCl2 + H2SO4 → BaSO4 + 2 HCl |
||
CuCl2 + NaOH → Cu(OH)Cl ↓ + NaCl |
||
Cu(OH)Cl + HCl → CuCl2 + HOH |
||
NaOH (aq) + HCl (aq) → NaCl (aq) + HOH (р) |
||
NaCl (aq) + AgNO3 (aq) → T ≈ 298 K, P ≈ 100 кПаNaNO3 (aq) + AgCl (тв) |
||
Ізомеризації |
перегрупування атомів у молекулі |
α
глюкоза |
18. 
Атом (електрони червоні)
В квантовій електродинаміці електрон описується рівнянням Дірака. У випадках, коли релятивістськими ефектами можна знехтувати, використовується рівняння Шредінгера. Електрон — частинка, для якої найяскравіше проявляються хвильові властивості. Дебройлівська довжина хвилі електрона має порядок розміру атома. Саме це дозволяє електрону зв'язуватися з ядром атома, а також брати участь в утворенні хімічних зв'язків між атомами у молекулі чи твердому тілі.
Ква́нтове число́ — індекс, який приписується стану квантової системи для його ідентифікації.
Здебільшого квантові числа мають додаткове фізичне значення. Фізичний стан може характеризуватися не одним, а кількома квантовими числами.
А́томною орбіта́ллю у квантовій механіці й хімії називають базисну хвильову функцію електрона в атомі.
Електронні орбіталі класифікують за орбітальними квантовими числами.
l =0. Такі орбіталі називаються s-орбіталями. Вони сферично симетричні.
![]() ,
,![]()
де — відповідні сферичні гармоніки, а f(r) — радіальна хвильова функція, яка залежить від інших квантових чисел і яка розраховується при розв'язанні стаціонарного рівняння Шредінгера.
l
= 1. Такі орбіталі називаються p-орбіталями й
мають витягнутий гантелеподібний
вигляд. Існує три (2l+1) p-орбіталі,
направлені вздовж трьох осей координат.
Їх позначають ![]() ,
, ![]() ,
, ![]() .
Три p-орбіталі відрізняються магнітним
квантовим числом m.
.
Три p-орбіталі відрізняються магнітним
квантовим числом m.
![]() ;
;
l
= 2. Такі орбіталі називаються d-орбіталями.
Існує п'ять d-орбіталей, які
позначаються ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() .
.
l = 3 відповідає семи f-орбіталям.
l = 4 відповідає дев'яти g-орбіталям.
[ред.]Гібридизація орбіталей
Згідно з принципом суперпозиції, якщо для електрона існує кілька різних станів, то для нього існує також можливість перебувати у всіх цих станах водночас. Електронні орбіталі складають базис у гільбертовому просторі хвильових функцій. У випадку, коли атом вступає в хімічні зв'язки, одночастинкова хвильова функція електрона в загальному випадку є суперпозицією орбіталей, утворюючи так звану молекулярну орбіталь. Це явище називають гібридизацією атомних орбіталей.
В органічній хімії велику роль відіграє гібридизація s і p-орбіталей атома вуглецю. В залежності від кількості та виду зв'язків, які утворює атом розрізняють sp3-гібридизацію(характерну для об'ємної структури алмазу), sp2-гібридизацію (характерну для плоскої структури графіту), sp1-гібридизацію (характерну для лінійної структури насичених полімерів).
19. При́нцип ви́ключення Па́улі (або принцип заборони Паулі)— квантово-механічний принцип, згідно з яким у багаточастинковій системі невзаємодіючих ферміонів, жодні дві частки не можуть описуватися одночастинковими хвильовими функціями із однаковим набором усіх квантових чисел.
Принцип був сформульований Вольфгангом Паулі в 1925 році. Він є наслідком принципу нерозрізнюваності часток (або принципу тотожності частинок).
Ферміони характеризуються тим, що їхні хвильові функції антисиметричні щодо перестановки ідентичних частинок. Щоб забезпечити антисиметричність, хвильову функцію системи багатьох ферміонів зазвичай будують за допомогою детермінанта Слейтера, використовуючи певний набір одночастинкових хвильових функцій. Із цих одночастинкових функцій не може бути двох однакових, бо згідно з властивостями визначника при двох однакових рядках чи стовпчиках визначник дорівнює нулю.
Правило Гунда- Електрони, заповнюючи даний енергетичний рівень, прагнуть заняти максимальну кількість орбіталів, розміщуючись на кажну по одній, щоб сумарний спін був максимальний
Правило Клечковского (також Правило n + l; також використовується назва правило Маделунга) - емпіричне правило, яке описує енергетичне розподіл орбіталей в багатоелектронних атомах.
Правило Клечковского говорить:
Заповнення електронами орбіталей в атомі відбувається в порядку зростання суми головного і орбітального квантових чисел. При однаковій сумі раніше заповнюється орбіталь з меншим значенням.
20.Періодичний закон — фундаментальний закон природи, який визначає, що властивості хімічних елементів, простих речовин, а також склад і властивості сполук перебувають у періодичній залежності від значень зарядів ядер атомів. Період горизонтальний ряд хімічних елементів, розміщених у порядку зростання їх атомних мас, що розпочинається лужним металічним елементом, та закінчуєтся інертним газом. хімічні елементи, розташовані в одному стовпці періодичної системи елементів і характеризуються подібністю хімічних власивостей завдяки спільним рисам у електронній конфігурації атомів.
22.Ковалентний зв'язок є формою хімічного зв'язку, характерною особливістю якого є те, що задіяніатоми поділяють одну чи більше спільних пар електронів, що і спричиняють їх взаємне притяжіння, яке утримує їх у молекулі.Ковалентний зв'язок найчастіше виникає між атомами із схожою високою електронегативністю. Ковалентний зв'язок найчастіше виникає між неметалами, тоді як іонний зв'язок є найпоширенішою формою зв'язку між атомами металів та неметалів.Ковалентний зв'язок, як правило, сильніший ніж інші типи зв'язку, такі як іонний. Ковалентний зв'язок поділяється на полярний і не полярний зв'язок.
Методи: З погляду методу валентних зв'язків чисельне значення валентності відповідає числу ковалентних зв'язків, що утворює атом. Оскільки в утворенні ковалентних зв'язків за В.Гейтлером і Ф.Лондоном беруть участь одноелектронні хмари, то валентність атома елемента визначається числом неспарених електроні. Валентністю елементів називається здатність їхніх атомів сполучатись з атомами інших елементів. За одиницю кількісної характеристики валентності елементів прийнято валентність Гідрогену.Гібридиза́ція орбіта́лей — суперпозиція різних, але близьких за енергією орбіталей даного атома, з виникненням того ж числа нових гібридних орбіталей, однакових за енергією. Гібридизація атомних орбіталей відбувається при виникненні ковалентних зв'язків між атомами.
23. Типи гібридизації : sp3-гібридизаціявідбувається при змішуванні однієї s- і трьох p-орбіталей, sp2-гібридизаціявідбувається при змішуванні однієї s- і двох p-орбіталей,sp-гібридизація відбувається при змішуванні однієї s- і однієї p-орбіталей. π-зв'язок (пі-зв'язок) — це ковалентний зв'язок, який утворюється перекриванням двох pz орбіталей. Обидві pz орбіталі є паралельними одно відносно одної. Сігма-зв'язок або σ-зв'язок — різновид ковалентного зв'язку, для якого характерна осьова симетрія. Міцність сігма-зв'язків пояснюється тим, що вони утворюються симетричною комбінацією атомних орбіталей, при якій електронна густина найбільша в області між атомами.
24.Донорно-акцепторний механізм, також координаційний механізм — механізм утворення ковалентного хімічного зв'язку за допомогою неподіленої електронної пари, яку надає один або група атомів (донор), і вільної орбіталі іншого атома чи групи атомів (акцептора). Утворені за таким механізмом зв'язки називають донорно-акцепторними або координаційними, хоча такі терміни не цілком коректні, оскільки йдеться не про окремий тип хімічного зв'язку, але лише про теоретичну модель, що описує його утворення. За властивостями зв'язки утворені за донорно-акцепторним механізмом нічим не відрізняються від утворених за обмінним механізмом.
25.Іо́нний хімі́чний зв'язо́к, також йонний хімічний зв'язок[1] — це тип зв'язку, при якому електрони переходять із одного атомадо іншого, й основний вклад в притягання вноситься електростатичною взаємодією.Утворюється між атомами або групами атомів зі значною різницею в електронегативностях.Характерний для сполук металів з найтиповішими неметалами. Кристалічні тверді тіла, утворені завдяки йонному зв'язку, називаються іонними кристалами. Прикладом такого кристалу є кам'яна сіль NaCl. До йонних кристалів належать також численні оксиди (MgO).
Водне́вий зв'язо́к — різновид хімічного зв'язку, що реалізується задонорно-акцепторним механізмом між двома ковалентно зв'язаними атомами з великим значенням електронегативності (О, N, F) за посередництвом атома Гідрогену Н. Водневий зв'язок є прикладом трицентрового чотириелектронного зв'язку.За величиною енергії він на порядок слабший за ковалентний зв'язок.
Водневий зв'язок є важливим для органічної хімії. Завдяки водневому зв'язку вода (головний розчинник у неорганічній хімії та біохімії) має високу температуру плавлення і кипіння. Водневий зв'язок з'єднує подвійну спіральДНК (носія генетичної інформації), а також відповідає за формування вторинної і третинної структури білків.
26.Пе́рший зако́н термодина́міки —зміна внутрішньої енергії закритої системи, яка відбувається в рівноважному процесі переходу системи із стану 1 в стан 2, дорівнює сумі роботи, зробленої над системою зовнішніми силами, і кількості теплоти, наданої системі . Перший закон термодинаміки сформульований в середині 19 століття в результаті робіт Саді Карно, Юліуса фон Маєра, Джеймса Прескотта Джоуля і Германа фон Гельмгольца. Перший початок термодинаміки часто формулюють як неможливість існування вічного двигуна 1-го роду, який здійснював би роботу, не черпаючи енергію з якого-небудь джерела.
Кількість теплоти або кількість тепла - фізична величина, яка характеризує процеси обміну енергією між тілами.Кількість теплоти, яка передається тілу, або відбирається від тіла в зворотніх рівноважних процесах, можна визначити із першого закону термодинаміки:
![]() ,де
Q - кількість теплоти, отриманої тілом,
,де
Q - кількість теплоти, отриманої тілом, ![]() -
зміна його внутрішньої
енергії,
A - робота,
виконана тілом над іншими тілами.
-
зміна його внутрішньої
енергії,
A - робота,
виконана тілом над іншими тілами.
27.Зако́н Ге́сса — тепловий ефект реакції при постійних об'ємі або тиску (коли відсутня не пов'язана з розширенням робота) не залежить від шляху реакції, а лише від початкового й кінцевого станів системи.
Ентальпі́я (або теплова
функція,
від грец. enthálpo —
«нагріваю») — повна
енергія системи,
яка складається із внутрішньої енергії
і добутку тиску на об'єм. Позначається ![]() або
або ![]() ,
де N — число частинок системи, xi —
інші макроскопічні параметри системи.
Ентальпія — адитивна функція, тобто
ентальпія всієї системи дорівнює сумі
ентальпій її складових частин. Із
внутрішньою енергією E системи ентальпія
зв'язана співвідношенням:
,
де N — число частинок системи, xi —
інші макроскопічні параметри системи.
Ентальпія — адитивна функція, тобто
ентальпія всієї системи дорівнює сумі
ентальпій її складових частин. Із
внутрішньою енергією E системи ентальпія
зв'язана співвідношенням:
![]() ,де
U - внутрішня енергія, P - тиск,
V - об'єм. Таким чином ентальпія дорівнює
сумі внутрішньої
енергії і
добутку тиску на об'єм.
,де
U - внутрішня енергія, P - тиск,
V - об'єм. Таким чином ентальпія дорівнює
сумі внутрішньої
енергії і
добутку тиску на об'єм.
Теплові ефекти. У кожному речовині запасено певну кількість енергії. З цією властивістю речовин ми стикаємося вже за сніданком, обідом або вечерею, так як продукти харчування дозволяють нашому організму використовувати енергію самих різноманітних хімічних сполук, що містяться в їжі. В організмі ця енергія перетворюється на рух, роботу, йде на підтримання постійної (і досить високою!) Температури тіла.
28. Другий закон термодинаміки: Для системи із сталою температурою існує певна функція стану S — ентропія, яка визначається таким чином, що
1. Адіабатичний перехід із рівноважного стану A в рівноважний стан B можливий лише тоді, коли
![]() .
.
2. Приріст ентропії в повільному квазістатичному процесі дорівнює
![]() ,де
T — температура
,де
T — температура
Адіаба́тний проце́с — в термодинаміці зміна стану тіла без обміну теплом з навколишнім середовищем.
Ентропія як фунція стану – це функція стану, яка характеризується тим, що різниця ентропій у двох різних точках дорівнює сумі зведених теплот, які треба витратити на перехід з початкового стану 1 у кінцевий стан 2 по оборотному шляху.
29.Ві́льна ене́ргія Гі́ббса — це термодинамічний потенціал такого вигляду:
![]() де
де ![]() — внутрішня
енергія,
— внутрішня
енергія, ![]() — тиск,
— тиск, ![]() — об'єм,
— об'єм, ![]() —
абсолютна температура,
—
абсолютна температура, ![]() — ентропія.
Енергію Гіббса можна розуміти як
повну хімічну
енергію системи
.Поняття енергії Гіббса широко
використовується в термодинаміці та хімії.
— ентропія.
Енергію Гіббса можна розуміти як
повну хімічну
енергію системи
.Поняття енергії Гіббса широко
використовується в термодинаміці та хімії.
Ізобарвно ізометричний потенціал
Хіміко-технологічними передумовами для такого рішення є відома здатність дигідрату сульфату кальцію розчинятись у фосфорній кислоті та вступати у хімічну взаємодію з утворенням малорозчинної речовини [1]: 6H++2P2-+3Ca2++3SO42- = Ca3(PO4)2+6H++3SO4 (1) Ізобарно-ізотермічний потенціал такої реакції при нормальних умовах складає 189.2 кДж/моль, що свідчить про однозначну спрямованість і ймовірність здійснення цієї реакції. При підвищених температурах (110…120С) ця реакція має зворотний напрямок, що використовується при виробництві фосфорних добрив.
30.Закон діючих мас швидкість реакції пропорційна добутку концентрацій реагентів у ступенях, щодорівнюють частинним порядкам реакційза реагентами.
Константа швидкості реакції (питома швидкість реакції) - коефіцієнт пропорційності в кінетичному рівнянні.Фізичний сенс константи швидкості реакції k випливає з рівняння закону діючих мас : k чисельно дорівнює швидкості реакції при концентрації кожного з реагуючих речовин дорівнює 1 моль / л.Константа швидкості реакції залежить від температури, від природи реагуючих речовин, але не залежить від їх концентрації.
31. Рівняння Ареніуса -EA/RT
k = k0e де k – константа швидкості реакції, ЕА – енергія активації (для хімічних реакцій ЕА = 40-400 кДж/моль), k0 – передекспоненційний множник Арреніуса, пропорційний числу зіткнень між молекулами.
Швидкість хімічної реакції визначається кількістю речовини, що прореагувала за одиницю часу в одиниці об’єму.
Формула
середньої швидкості хімічної реакції: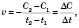 де
де ![]() —
середня швидкість хімічної реакції,
—
середня швидкість хімічної реакції, ![]() —
зміна концентрації реагенту,
—
зміна концентрації реагенту, ![]() —
час.
—
час.
32.Каталіза́тор — речовина, яка змінює швидкість хімічних реакцій, (найчастіше знижуючи її енергію активації), а сама після реакції залишається хімічно незмінною і в тій же кількості, що й до реакції.
Гомогенний каталіз.Гомогенний каталіз може протікати у газоподібній чи рідкій фазах при відповідному стані каталізатора. На перший план виходять умови перебігу реакцій: концентрації реагентів, температура, тиск, інтенсивність перемішування. Механізм гомогенного каталізу полягає в утворенні між реагентами та каталізатором малостійких проміжних сполук, що існують у тій самій фазі і після розпаду яких каталізатор регенерується.
Гетерогенний каталіз. Легкість відділення газової або рідкої реакційної суміші від твердого каталізатору послугувала причиною широкого використання гетерогенного каталізу. Більшість нині існуючих промислових процесів — реакції між газоподібними реагентами за участі твердих каталізаторів.
33.Необоро́тні реа́кції — реакції, при яких узяті речовини без остачі перетворюються на продукти реакції, що не реагують між собою за даних умов, наприклад, розкладання вибухових речовин, горіння вуглеводнів, утворення малодисоціюючих з'єднань, випадання осаду, утворення газоподібних речовин.
Оборотний процес в термодинаміці, процес переходу термодинамічної системи з одного стану в інше, що допускає можливість повернення її в первинний стан через ту ж послідовність проміжних станів, але прохідних в зворотному порядку.
Рівнова́га термодинамі́чної систе́ми — стан, при якому термодинамічна система займає певний об'єм, і перебуває у рівноважному стані (стані рівноваги). Такий стан є тоді, колитиск, температура і хімічний склад системи в усіх її частинах, якими малими вони б не були, є однаковими.
34.Константа рівноваги 1) Відношення пружності пари індивідуального вуглеводню Q до тиску суміші вуглеводнів рс: k = Q/pc.
2) Відношення молярної частки уі і-ого компонента багатокомпонентної системи в паровій (газовій) фазі до молярної частки хі цього ж компонента в рідинній фазі при даних тиску і температурі або відношення тиску насиченої пари рі і-ого компонента багатокомпонентної системи при заданій температурі до тиску р в багатокомпонентній системі при цій же температурі, тобто . Визначена таким чином константа рівноваги зберігає свою величину до тисків у декілька десятих МПа.
Принцип Лешательє-Брауна[1] стверджує, що реакція рівноважної термодинамічної системи на будь-яке збурення відбувається таким чином, щоб зменшити наслідки цього збурення.
![]() ,
де
,
де ![]() -
величина того відклику, яка спостерігалася
б при зафіксованому стані системи,
-
величина того відклику, яка спостерігалася
б при зафіксованому стані системи, ![]() -
справжня величина відклику, коли система
реагує на збурення зміною свого стану.
-
справжня величина відклику, коли система
реагує на збурення зміною свого стану.
35. Рóзчини — цілком однорідні суміші з двох (або кількох) речовин, в яких молекули (або іони) одної речовини рівномірно розподілені між молекулами другої речовини.Розчини характеризуються також рядом певних властивостей, відмінних від властивостей їх складових частин. Зокрема, вони відрізняються від своїх складових частин густиною, температурою замерзання і кипіння і іншими властивостями. Розчини можуть бути в рідкому, твердому і газоподібному стані. Прикладом перших можуть служити розчини цукру, солі іспирту у воді. Тверді розчини — це різні металічні сплави: міді або срібла в золоті, нікелю в міді тощо. Газоподібними розчинами є суміші різних газів, наприклад повітря.
Дисперсна фаза - частина дисперсної системи. Розподілена (розосереджена) по останній дисперсна фаза може являти собою дрібні тверді частинки (зерна), краплі рідини або бульбашки газу. Дисперсні системи з частинками дисперсної фази крупнішими 10-4 см називають грубодисперсними, з частинками менших розмірів - високодисперсними або колоїдними.
Дисперсі́йне середо́вище (рос. дисперсионная среда, англ. dispersionmedium; нім. Dispersionsmedium n) — середовище, в якому розміщені частинки подрібненої речовини.Дисперсійне середовище разом з цими частинками (дисперсною фазою) називають дисперсною системою (нап, суспензія, молоко, туман, дим).Дисперсійне середовище — компонент або компоненти дисперсної системи, що утворюють безперервну фазу.
Суспензія (від пізньолат. suspensio - підвішування) — дисперсна система з рідким дисперсійним середовищем та твердою диспергованою (дисперсною) фазою, частинки якої достатньо великі, щоб протидіяти броунівському руху. На відміну від високодисперсних систем, в суспензії частинки відносно швидко седиментують (випадаюсть в осад, або зрідка спливають на поверхню дисперсіної рідини).Суспензії використовують у будівельній технології, виробництві лакофарбових матеріалів, паперу тощо.
Ему́льсія — дисперсна система з рідким дисперсійним середовищем та рідкою дисперсною фазою.Складається з двох взаємно нерозчинних рідин, одна з яких рівномірно розподілена в другій у вигляді найдрібніших крапель, а розміри розпорошених часточок є більшими від характерних для колоїдів. При визначенні назви першою називають дисперсну фазу, а потім дисперсійне середовище, напр. вода в маслі, бензол у воді тощо (напр., молоко — Е., де краплинки жиру розподілені у водному середовищі). Е. низької концентрації — неструктуровані рідини. Висококонцентровані Е. — структуровані системи.
Розчин колоїдний – високодисперсні системи, в яких, на відміну від справжніх розчинів, зберігаються поверхні розділу між дисперсійним середовищем та диспергованою речовиною.
36.Процес розчинення кожної речовини у воді супроводжується або виділенням, або поглинанням тепла, внаслідок чого одержуваний розчин або нагрівається, або охолоджується. Розчинення газоподібних речовин завжди супроводжується виділенням тепла і нагріванням розчину. При розчиненні багатьох рідин у воді, наприклад спирту і сульфатної кислоти, теж виділяється значна кількість тепла і розчин сильно нагрівається. При розчиненні твердих речовин у воді інколи виділяється, а інколи поглинається тепло.
Гідрат – речовина, яка містить зв'язані молекули води, що можуть входити і в її структуру. Стійкі гідрати виділяються з розчинів у формі кристалогідратів. Кристалогідрати характерні для природних горючих газів.
Кристалогідра́ти — кристалічні речовини, в складі молекул яких є кристалізаційна вода, напр. гідрат хлористого кальцію.Кристалогідрати — порівняно стійкі гідрати, які можна виділити з розчину у твердому стані. Деякі з них поступово розкладаються вже при звичайній температурі.
37.
Насичений розчинУ певній кількості води при даній температурі може розчинятися лише певна кількість речовини, а надлишок її залишається нерозчинним. Розчин, у якому взята речовина при даній температурі більше не розчиняється, називається насиченим.При виготовленні насиченого розчину до розчинника додають звичайно таку кількість розчинюваної речовини, щоб частина її залишалася нерозчинною, скільки б розчин не розмішували і не збовтували. Однак у практиці звичайно користуються ненасиченими розчинами, тобто такими, в яких при даній температурі розчинювана речовина може ще розчинятися (до утворення насиченого розчину).
Пересичений розчин Крім насичених і ненасичених, відомі ще так звані пересичені розчини, в яких розчинюваної речовини в розчиненому стані більше, ніж потрібно для одержання насиченого розчину. Але пересичені розчини зустрічаються порівняно рідко, і їх утворюють лише деякі речовини, наприклад декагідрат сульфату натрію — Na2SO4•10H2O, пентагідраттіосульфату натрію — Na2S2O3 • 5H2O тощо. Пересичені розчини дуже нестійкі і досить легко розкладаються з виділенням надлишку розчиненої речовини і утворенням насиченого розчину.
Розчин пересичений, розчин метастабільний – гетерогенна нерівноважна система з невеликим ступенем стійкості, яка переходить у нестабільний стан в результаті дуже незначного впливу; напр., внесення в такий розчин кристалу розчиненої речовини спричиняє бурхливе випадання з розчину твердої фази. У природних водах ступінь пересичення окремих солей значно вищий від їх пересичення в чистій воді .
38.КОНЦЕНТРАЦІЯ РОЗЧИНІВ — це величина, яку вимірюють масою або об’ємом розчиненої речовини, що міститься у певній масі або об’ємі розчину або розчинника. Найчастіше використовують такі способи вираження концентрації: масова частка, молярна, моляльна концентрація, молярна концентрація еквівалента, молярна частка, об’ємна частка та титр. Масову частку речовини Х w(Х) розраховують за формулою:
![]()
Масова частка елемента в речовині — це фізична величина, що визначається відношенням маси, яка припадає на елемент, до маси всієї речовини. Масова частка позначається W (читається дубль-ве) і виражається у частках одиниці або у відсотках. Спосіб обчислення полягає у знаходженні частини від цілого за формулою: W = nAr / Mr де W — масова частка елемента; Аr — відносна атомна маса елемента; n — кількість атомів елемента у формулі; Мr — відносна молекулярна або формульна маса речовини.
Приклад. Обчисли масову частку Алюмінію у глиноземі Аl2О3. Дано: Аl2O3 Розв' язання. W(Al) = ? Мr(Аl2О3) = 2Аr(Аl) + ЗАr(O); Мr(Аl2О3) = 2 • 27 + 3 • 16 = 102; W(Al) = 54/102 = 0,53, або 53 % Відповідь. Масова частка Алюмінію в глиноземі становить 53 %.
Молярний розчин --- розчин, в якому число грамів розчиненої речовини, що припадає на один літр розчину, збігається з його молекулярної масою, тобто розчин, молярність якого дорівнює 1 М.
39 Осмоти́чний ти́ск (або дифу́зний ти́ск) — термодинамічний параметр, що характеризує прагнення розчину понизити свою концентрацію при зіткненні з чистим розчинником внаслідок зустрічної дифузії молекул розчинника та розчиненої речовини.
Вант-Гоффа закон
осмотического давления, определяет давление молекул растворённого вещества на полупроницаемую перепонку, отделяющую раствор от чистого растворителя и непроницаемую для растворённого вещества
40 Залежність зниження тиску пари розчинів від їхньої концентрації виражається першим законом Рауля (1887р.): відносне зниження тиску насиченої пари над розчином прямопропорційне мольній частці розчиненої речовини.
Первый закон Рауля связывает давление насыщенного пара над раствором с его составом; он формулируется следующим образом:
Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
![]()
41 підвищення температури кипіння, або зниження температури замерзання розчину прямопропорційне молярній концентрації розчиненої речовини. Коефіцієнти пропорційності називають відповідно ебуліоскопічна і кріоскопічна сталі. Значення коефіцієнтів залежать лише від природи розчинника.
Зако́н
Рау́ля (рос. закон
Рауля; англ. Raoult’s
law; нім. Raoultsches
Gesetzn) — парціальні
тиски рі пари
кожного з компонентів ідеального
розчину при постійній температурі є
пропорційними до молярних часток цих
компонентів в рідкій фазі ![]() :
:
![]() ,
,
де ![]() —
пружність пари чистого розчинника.
—
пружність пари чистого розчинника.
42 Відхилення властивостей розчинів електролітів від законів, що описують властивості розчинів неелектролітів, є наслідком дисоціації електролітів на їх складові частинки.
Ступінь електролітичної дисоціації
Здатність
електроліту дисоціювати на іони
кількісно оцінюється за допомогою
ступеня
дисоціації.
показує, яка частка від загального
числа молекул розчиненої речовини
розпалася на іони (продисоціювала):
=  ,
де С
– молярна концентрація розчину (моль/л).
часто виражають і в процентах:
·100%.
За величиною ступеня дисоціації розчинів
усі електроліти поділяють на сильні і
слабкі.
,
де С
– молярна концентрація розчину (моль/л).
часто виражають і в процентах:
·100%.
За величиною ступеня дисоціації розчинів
усі електроліти поділяють на сильні і
слабкі.
43 Теорія електролітичної дисоціації
Основні положення теорії електролітичної дисоціації, сформульовані СвантеАрреніусом, наступні:
Електроліти при розчиненні або в розплаві дисоціюють на іони.
При проходженні електричного струму через розчин або розплав електроліту спостерігається напрямлений рух іонів: позитивно заряджені іони (катіони) рухаються до катоду; негативно заряджені іони (аніони) рухаються до аноду.
Процес дисоціації є оборотнім.
Константа рівноваги слабкого електролітуК називається константою дисоціації Кдис. Чим менше значення Кдис., тим слабкішим є електроліт. Кдис. залежить від температури і не залежить від концентрації розчину.
44 Експериментальні
значення величин р,
росм.,
tкип,
tзам.
для розчинів електролітів більші за
теоретично обчислені за відповідними
законами Рауля і Вант-Гоффа. Тому для
оцінки міри відхилення розчинів
електролітів від розбавлених розчинів
неелектролітів Вант-Гофф запропонував
ввести так званий поправочний, або
ізотонічний коефіцієнт (і),
який є відношенням відповідних
експериментальних значень величин до
теоретично обчислених: і =  =
=  =
=  =
=  .
Ізотонічний коефіцієнт і > 1.
.
Ізотонічний коефіцієнт і > 1.
Між
константою і ступенем електролітичної
дисоціації існує зв’язок, відомий під
назвою закону
розведення Оствальда.
Запишемо рівняння дисоціації слабкого
електроліту: КА К++А–
Нехай його концентрація – С (моль/л),
ступінь дисоціації ;
тоді число продисоційованих молекул
рівне С,
а число кожного з іонів [К+] = [А–] = .
Число недисоційованих молекул рівне
С–С = С
(1–)
і Кдис. =  =
=  =
=  .
Якщо електроліт слабкий, то
.
Якщо електроліт слабкий, то  1,
тоді Кдис.. = С2,
звідси =
1,
тоді Кдис.. = С2,
звідси =  .
З рівняння випливає висновок, що із
зменшенням концентрації електроліту
ступінь його дисоціації збільшується.
.
З рівняння випливає висновок, що із
зменшенням концентрації електроліту
ступінь його дисоціації збільшується.
46 Слабкі електролітиу розчинах дисоціюють частково. Ступінь їх дисоціації має значення менші ніж 2-3% (а<2-3%).До них належать більшість органічних кислот, неорганічні кислоти H2S, H2SO3, H2SiO3, Н2СO3, HNO2, HCN та ін., нерозчинні у воді гідроксиди металів, гідроксид амонію, вода.
Зако́н розба́влення О́ствальда — співвідношення, що виражає залежність еквівалентної електропровідності розведеного розчину бінарного слабкого електроліту від концентрації розчину.
![]()
Де
К — константа
дисоціаціїелектроліту,
с — концентрація, λ і λ∞ — значення
еквівалентної електропровідності
відповідно при концентрації
![]() і
при нескінченному розведенні. Це
співвідношення є наслідком закону
діючих мас
і рівності
і
при нескінченному розведенні. Це
співвідношення є наслідком закону
діючих мас
і рівності
![]()
де α — ступінь дисоціації.
47 Іонний добуток води
Чиста
вода є слабким електролітом: при 22 оС
ступінь її дисоціації складає 1,8·10–9.
Рівняння дисоціації води: Н2О Н++ОН–
і Кдис. =  ,
тоді Кдис·[Н2O] = [H+]·[OH–].
Практично [Н2O] = const,
звідси Кдис·[Н2O] = [H+]·[OH–] = K
,
тоді Кдис·[Н2O] = [H+]·[OH–].
Практично [Н2O] = const,
звідси Кдис·[Н2O] = [H+]·[OH–] = K .
K
називається іонним
добутком води:
.
K
називається іонним
добутком води:
В
1 л Н2О,
що має масу 1 кг (1000 г.), число моль
Н2О
складає
 = 55,56 моль/л.
Кдис(Н2O) = 1,8·10–9,
тоді [H+] = [OH–] = 55,56·1,8·10–9 = 10–7,
а [H+]·[OH–] = 10–14.
При даній температурі K
є сталою величиною. При 22 оС
нейтральні розчини мають однакову
концентрацію [H+] = [OH–] = 10–7 моль/л
і K
= 10–14.
Це дає змогу обчислювати концентрацію
[H+]
або [OH–]:
[H+] =
= 55,56 моль/л.
Кдис(Н2O) = 1,8·10–9,
тоді [H+] = [OH–] = 55,56·1,8·10–9 = 10–7,
а [H+]·[OH–] = 10–14.
При даній температурі K
є сталою величиною. При 22 оС
нейтральні розчини мають однакову
концентрацію [H+] = [OH–] = 10–7 моль/л
і K
= 10–14.
Це дає змогу обчислювати концентрацію
[H+]
або [OH–]:
[H+] =  і [OH–]
=
і [OH–]
=  .
.
