
- •Парентеральные растворы
- •Содержание
- •Вводная часть
- •1.1. Введение
- •1.2. Список сокращений и аббревиатур
- •Классификация и характеристика парентеральных лекарственных средств
- •Парентеральные лекарственные средства Классификация
- •Растворители
- •2.3. Вода для фармацевтических целей
- •2.3.1. Методы получения
- •2.3.3. Хранение и распределение вди
- •3. Надлежащая практика производства (gmp)
- •Основные разделы гост р 52249-2009
- •Часть 1. Основные требования
- •Часть 2. Основные требования к активным фармацевтическим субстанциям (афс), используемым в качестве исходных материалов (19 глав).
- •4. Инъекционные растворы
- •4.1. Требования к инъекционным растворам
- •4.2. Изготовление ампул
- •4.3. Технологический процесс производства ир
- •4.3.1. Приготовление и фильтрация инъекционных растворов
- •4.3.2. Способы обработки ампул
- •Шприцевой метод ампулирования
- •Вакуумный метод ампулирования
- •4.3.3. Стерилизация
- •4.4.4. Контроль показателей качества инъекционных лс
- •Лабораторные работы по теме «Инъекционные растворы»
- •5.1. Перечень оборудования, приборов, посуды для лабораторных работ
- •5.2. Методика выполнения работ по ампулированию ир
- •5.2.1. Мойка ампул
- •5.2.2. Сушка ампул
- •5.2.3. Приготовление инъекционного раствора
- •5.2.4. Фильтрование раствора
- •5.2.5. Наполнение ампул
- •5.2.6. Промывка капилляров ампул
- •5.2.7. Запайка ампул
- •5.2.8. Термическая стерилизация ампул
- •Инструкция по работе со стерилизатором
- •5.2.9. Проверка герметичности ампул
- •5.2.10. Отбраковка некачественных ампул
- •5.2.11. Упаковка и оформление готовой продукции
- •Лабораторная работа №1
- •1.1. Входной контроль ампул
- •1.2. Разбавление и укрепление инъекционных растворов
- •Теоретическая часть
- •Методика выполнения работы
- •Контрольные тесты.
- •Лабораторная работа № 2 Стабилизация инъекционных растворов
- •Теоретические основы работы
- •Методика выполнения работы
- •Контрольные тесты
- •Лабораторная работа № 3 Асептическое приготовление инъекционных растворов
- •Теоретические основы работы
- •Методика выполнения работы
- •Характеристика препаратов
- •Контрольные тесты
- •6. Инфузионные растворы
- •6.1. Состав, функции и свойства крови
- •Состав плазмы крови (%)
- •6.2. Характеристика инфузионных лекарственных средств
- •6.3. Классификация инфузионных растворов
- •6.4. Технология производства инфузионных растворов
- •6.4.1. Требования к инфузионным растворам
- •6.4.2. Особенности технологии инфузионных растворов
- •6.4.3. Упаковка инфузионных растворов
- •Мягкая полимерная упаковка
- •Технология Blow-Fill-Seal (bfs)
- •6.4.4. Стерилизация ифр
- •7. Лабораторные работы по теме
- •Лабораторная работа №4
- •4.1. Электролитные растворы.
- •4.2. Осмолярность. Методы определения
- •Теоретические основы работы
- •Методы определения осмолярности
- •Расчет теоретической осмолярности
- •Определение фактической осмолярности
- •2.1. Криометрический метод
- •2.2. Расчетно –графический способ
- •Методика выполнения работы
- •Контрольные тесты
- •Лабораторная работа №5
- •5.1. Гидролиз желатина
- •5.2. Раствор Желатиноль для инфузий
- •Теоретические основы работы
- •Методика выполнения работы
- •5.1. Гидролиз желатина
- •Набухание желатина
- •Определение относительной вязкости раствора желатина
- •. Раствор Желатиноль для инфузий
- •Методика выполнения работы
- •Контрольные тесты
- •8. Сырье, материалы, реактивы
- •9. Ответы к контрольным тестам
- •10. Рекомендуемая литература Основная литература
- •Дополнительная литература
Теоретические основы работы
Большую долю ИФР составляют растворы электролитов. В их состав входят соли, диссоциирующие в водных растворах на ионы, которые присутствуют в плазме крови: Na+, К+, Са2+, Mg2+, Cl-, HCO3-, HPO42-, SO42- и др. Важным физико-химическим показателем электролитных ИФР является осмолярность.
Осмолярность – один из основных параметров мониторинга системы кровообращения для объективной оценки программы комплексной интенсивной транс- и инфузионной терапии. Это жизненно важный показатель нормализации водносолевого баланса, белкового обмена и микроциркуляции крови. По величине осмолярности можно рассчитать количество вводимых осмотически активных веществ на 1 кг массы тела в сутки.
Осмолярность – суммарная мольная концентрация в единице объема раствора кинетически активных частиц, то есть молекул, ионов, ионных комплексов, создающих определенное осмотическое давление. Поскольку между осмотическим давлением и осмолярностью существует линейная зависимость, по значению осмолярности можно судить о соответствующем осмотическом давлении, величина которого учитывается при инфузионной терапии.
Различают осмолярность теоретическую, которую рассчитывают исходя из номинального состава раствора и фактическую, определяемую или экспериментально, или расчетно-графическим способом.
Методы определения осмолярности
Расчет теоретической осмолярности
Теоретическую осмолярность (мОсмоль/л) рассчитывают при условии предположительно полной диссоциации всех молекул солей, присутствующих в растворе, по формуле (4.1). Поскольку мольные концентрации очень малы, их выражают, для удобства расчетов, в миллимоль/л.
Сосм =
![]() (4.1)
(4.1)
где m1,
m2,…, mi![]() - масса 1-го, 2-го, …i-го
вещества в 1 л раствора, г;
- масса 1-го, 2-го, …i-го
вещества в 1 л раствора, г;
М1, М2,…, Мi - молярная масса 1-го, 2-го, …i-го вещества, г/моль;
n1, n2, …, ni- количество ионов, образующихся из молекулы при условии полной диссоциации 1-го, 2-го, …i-го вещества;
1000 – коэффициент перевода моль в ммоль.
Пример расчета осмолярности раствора Дисоль
Состав:
NaCl 6 г
CH3COONa 2 г
Воды для инъекций до 1 л
Сосм
=![]()
Согласно современным требованиям маркировки на этикетке контейнера с ИФР необходимо указывать не только теоретическую осмолярность, но и количественный ионный состав.
Пример расчета ионного состава раствора Дисоль
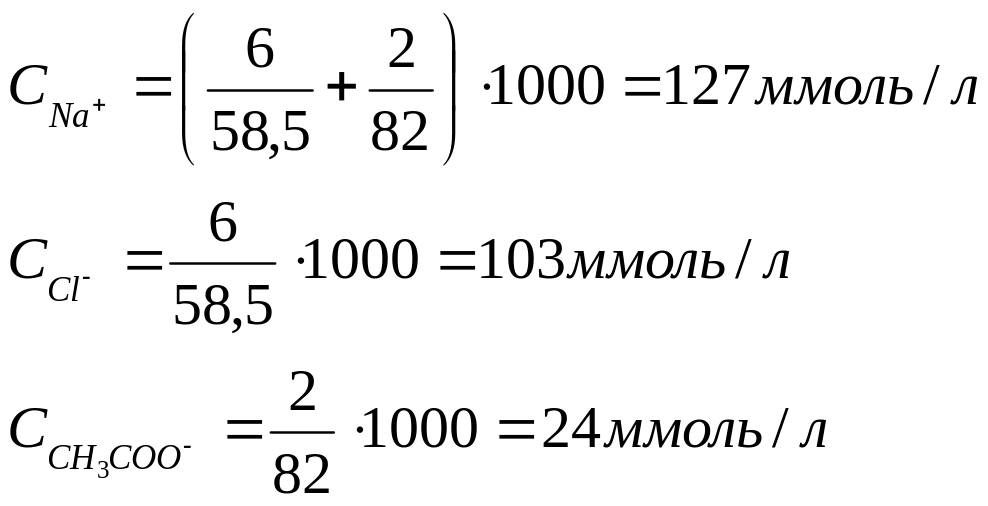

Итого: 254 мОсмоль/л
Определение фактической осмолярности
Фактически значение осмолярности всегда ниже расчетного, так как в реальных растворах полной диссоциации молекул не происходит вследствие электростатического взаимодействия между ионами. В многокомпонентных системах наблюдается значительный разброс активности отдельных неорганических ионов из-за их взаимного влияния и разброс фактической осмолярности.
Существует несколько экспериментальных методов определения осмолярности водных растворов:
По понижению температуры замерзания раствора по сравнению с чистым растворителем (криометрический метод);
По различию между давлением пара над раствором и чистым растворителем (паровая осмометрия).
По способности полупроницаемых мембран избирательно пропускать молекулы веществ (мембранная осмометрия). Применяется только для растворов высокомолекулярных веществ.
