
- •Парентеральные растворы
- •Содержание
- •Вводная часть
- •1.1. Введение
- •1.2. Список сокращений и аббревиатур
- •Классификация и характеристика парентеральных лекарственных средств
- •Парентеральные лекарственные средства Классификация
- •Растворители
- •2.3. Вода для фармацевтических целей
- •2.3.1. Методы получения
- •2.3.3. Хранение и распределение вди
- •3. Надлежащая практика производства (gmp)
- •Основные разделы гост р 52249-2009
- •Часть 1. Основные требования
- •Часть 2. Основные требования к активным фармацевтическим субстанциям (афс), используемым в качестве исходных материалов (19 глав).
- •4. Инъекционные растворы
- •4.1. Требования к инъекционным растворам
- •4.2. Изготовление ампул
- •4.3. Технологический процесс производства ир
- •4.3.1. Приготовление и фильтрация инъекционных растворов
- •4.3.2. Способы обработки ампул
- •Шприцевой метод ампулирования
- •Вакуумный метод ампулирования
- •4.3.3. Стерилизация
- •4.4.4. Контроль показателей качества инъекционных лс
- •Лабораторные работы по теме «Инъекционные растворы»
- •5.1. Перечень оборудования, приборов, посуды для лабораторных работ
- •5.2. Методика выполнения работ по ампулированию ир
- •5.2.1. Мойка ампул
- •5.2.2. Сушка ампул
- •5.2.3. Приготовление инъекционного раствора
- •5.2.4. Фильтрование раствора
- •5.2.5. Наполнение ампул
- •5.2.6. Промывка капилляров ампул
- •5.2.7. Запайка ампул
- •5.2.8. Термическая стерилизация ампул
- •Инструкция по работе со стерилизатором
- •5.2.9. Проверка герметичности ампул
- •5.2.10. Отбраковка некачественных ампул
- •5.2.11. Упаковка и оформление готовой продукции
- •Лабораторная работа №1
- •1.1. Входной контроль ампул
- •1.2. Разбавление и укрепление инъекционных растворов
- •Теоретическая часть
- •Методика выполнения работы
- •Контрольные тесты.
- •Лабораторная работа № 2 Стабилизация инъекционных растворов
- •Теоретические основы работы
- •Методика выполнения работы
- •Контрольные тесты
- •Лабораторная работа № 3 Асептическое приготовление инъекционных растворов
- •Теоретические основы работы
- •Методика выполнения работы
- •Характеристика препаратов
- •Контрольные тесты
- •6. Инфузионные растворы
- •6.1. Состав, функции и свойства крови
- •Состав плазмы крови (%)
- •6.2. Характеристика инфузионных лекарственных средств
- •6.3. Классификация инфузионных растворов
- •6.4. Технология производства инфузионных растворов
- •6.4.1. Требования к инфузионным растворам
- •6.4.2. Особенности технологии инфузионных растворов
- •6.4.3. Упаковка инфузионных растворов
- •Мягкая полимерная упаковка
- •Технология Blow-Fill-Seal (bfs)
- •6.4.4. Стерилизация ифр
- •7. Лабораторные работы по теме
- •Лабораторная работа №4
- •4.1. Электролитные растворы.
- •4.2. Осмолярность. Методы определения
- •Теоретические основы работы
- •Методы определения осмолярности
- •Расчет теоретической осмолярности
- •Определение фактической осмолярности
- •2.1. Криометрический метод
- •2.2. Расчетно –графический способ
- •Методика выполнения работы
- •Контрольные тесты
- •Лабораторная работа №5
- •5.1. Гидролиз желатина
- •5.2. Раствор Желатиноль для инфузий
- •Теоретические основы работы
- •Методика выполнения работы
- •5.1. Гидролиз желатина
- •Набухание желатина
- •Определение относительной вязкости раствора желатина
- •. Раствор Желатиноль для инфузий
- •Методика выполнения работы
- •Контрольные тесты
- •8. Сырье, материалы, реактивы
- •9. Ответы к контрольным тестам
- •10. Рекомендуемая литература Основная литература
- •Дополнительная литература
Теоретические основы работы
В процессе приготовления, термической стерилизации и длительного хранения ИР могут подвергаться необратимым изменениям, которые проявляются в сдвиге рН, изменении или появлении окраски, образовании взвеси или эмульсии, изменении количественного содержания АДВ. Наиболее часто встречаются следующие химические процессы:
Гидролиз
Гидролизу подвержены соли неорганических и органических кислот, сложные эфиры, амиды, лактоны, углеводы, гликозиды и т. п. Степень гидролиза зависит от природы соединения и концентрации раствора. В зависимости от ионного состава вещества различают два варианта гидролиза:
1. Соли сильных оснований и слабых кислот
Например, гидролиз натрия нитрита протекает по уравнению:
NaNO2 + Н2О Na+ + ОН– + НNО3
Стабилизация растворов таких солей достигается добавлением одного из ионов, образующихся в результате гидролиза, в данном случае раствора NaOH. Согласно принципу Ле Шателье равновесие реакции смещается влево и гидролиз подавляется.
2. Соли сильных кислот и слабых оснований
К этой группе относятся многие соли, образованные алкалоидами и неорганическими кислотами. Например, атропина сульфат, лобелина гидрохлорид, тиамина бромид и др. Гидролиз протекает по уравнению:
Alk · HA + Н2O Alk + Н3О+ + А–
В результате гидролиза образуется основание алкалоида. Если основание нерастворимо или трудно растворимо в воде, в растворе появляется его осадок (растворы дибазола, стрихнина нитрата, папаверина гидрохлорида и др.). Если основание в воде растворимо, могут происходить дальнейшие химические процессы, сопровождающиеся изменением окраски (пожелтение раствора морфина, зеленая окраска раствора апоморфина, розовая окраска раствора адреналина и т. д.). Для смещения реакции гидролиза влево такие растворы стабилизируют добавлением кислоты.
Гидролиз солей часто является лишь началом последующих процессов разложения (последующий гидролиз сложных эфиров, окисление, полимеризация, деструкция и т.д.). Примером может служить
Инъекционный раствор новокаина (прокаина).
На первой ступени происходит гидролиз новокаина гидрохлорида по кислотной группировке с образованием новокаина основания (замасливание стенок ампулы).

Затем происходит гидролиз основания по сложноэфирной группировке (сильный сдвиг рН):
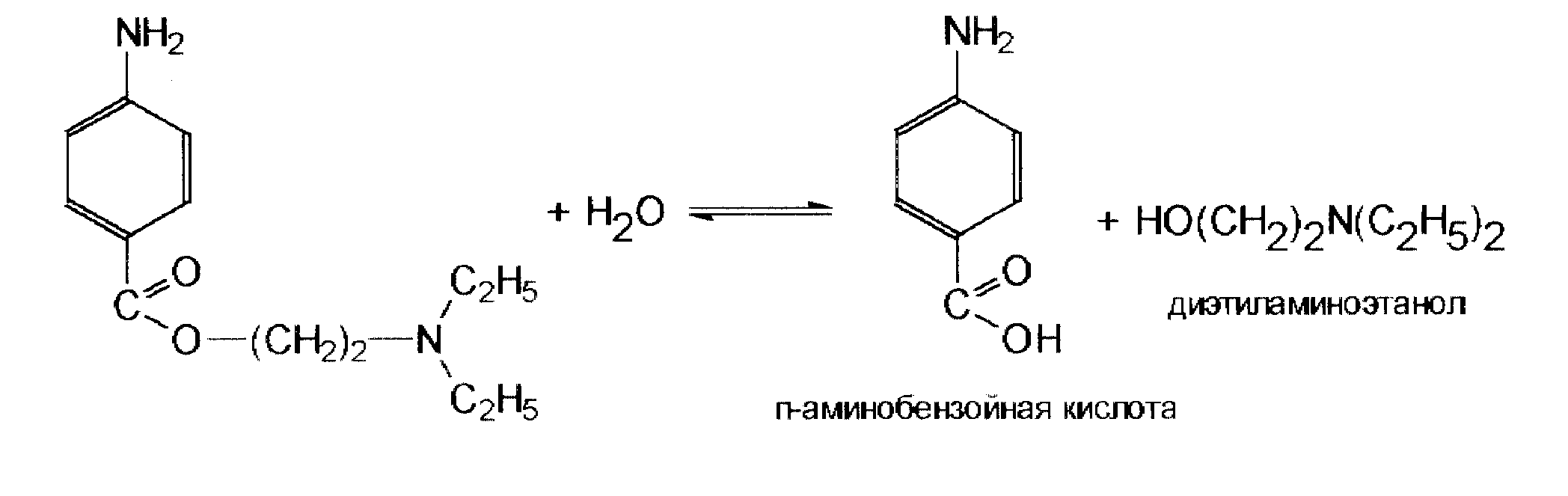
Нагревание в процессе стерилизации п-аминобензойной кислоты приводит к образованию анилина, ядовитого вещества, который связывает гемоглобин и вызывает отек при введении в организм, одышку, посинение.
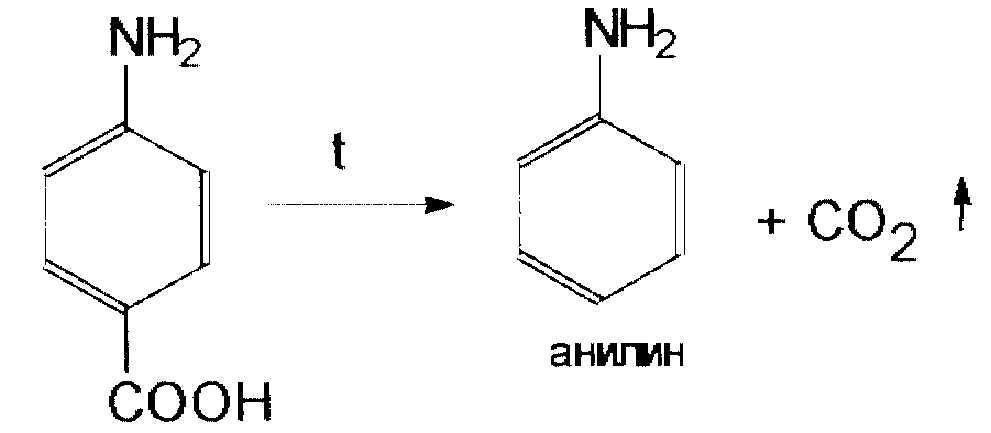
Поэтому для стабилизации растворов новокаина добавляют хлористоводородную кислоту до оптимального значения рН, при котором гидролиз подавляется уже на первой ступени.
Инъекционный раствор тримекаина
 СН3 C2H5
СН3 C2H5



 NH-C-CH2-N
*HCl*1/2H2O
С14Н22ОN2*HCl
NH-C-CH2-N
*HCl*1/2H2O
С14Н22ОN2*HCl
СН3 O C2H5
Тримекаин (2,4,6-триметилацетанилидадиэтиламиноуксусной кислоты гидрохлорид или α-диэтиламино-2,4,6-триметилацетанилида гидрохлорид).
Синонимы: мезокаин, мездикаин.
В отличие от новокаина тримекаин не является сложным эфиром и может гидролизоваться только при длительном кипячении с кислотой или щелочью. Важно, чтобы рН раствора находился в пределах 4,5-5,2, т.к. при его снижении происходит падение фармакологической активности. Готовят на изотоническом растворе натрия хлорида, чтобы снизить болезненность при введении. Наряду с местноанестезирующей активностью препарат обладает выраженным антиаритмическим действием.
Окисление
Окислению подвержены вещества с подвижным атомом водорода, т. е. содержащие фенольные, спиртовые, карбонильные, амино- и другие группы. Для стабилизации таких растворов используют и химические вещества и технологические приемы, повышающие их устойчивость:
— подбор оптимального рН;
— введение антиоксидантов;
— введение комплексонов для связывания катионов тяжелых металлов.
— использование светозащитного стекла;
— уменьшение содержания кислорода в растворе и вытеснение воздуха из ампул.
Антиоксиданты — вещества, которые являются сильными восстановителями. В ИР они окисляются легче АДВ и таким образом защищают его от разложения. В производстве ИР широко применяют в качестве антиоксидантов соли сернистой кислоты: Na2SO3 (натрия сульфит), NaHSO3 (натрия гидросульфит), Na2S2O5 (натрия метабисульфит), а также S=С(NН2)2 (тиомочевина), H3COSO2Na · H2O (ронгалит).
В некоторых случаях для удаления катионов тяжелых металлов, которые катализируют окислительные процессы, ИР обрабатывают сорбентами. Например, в технологии 40% раствора глюкозы предусмотрена обработка его активным углем (марок А, Б, ОУ-А, ОУ-Б и др.) или фильтрование через угольноволоконные сорбционные фильтры.
Комплекс мероприятий для защиты АДВ от разложения применяется в производстве растворов аскорбиновой кислоты для инъекций. Аскорбиновая кислота, из-за наличия в составе ее лактамной и енольной групп, легко окисляется на воздухе даже в твердой фазе. Для защиты от окисления в состав ИР вводят антиоксидант, а для сдвига рН вводят натрия гидрокарбонат, который переводит аскорбиновую кислоту в соль. Это исключает болезненность при инъекции. Готовят ИР на воде, насыщенной диоксидом углерода, и запайку ампул производят также в токе диоксида углерода (газовая защита).
Для газовой защиты ИР используют и другие инертные газы (азот, аргон), очищенные от примесей механических частиц путем фильтрования. При выборе инертного газа учитывают свойства самого газа и стабилизируемого раствора. Например, углекислый газ не рекомендуется использовать для растворов с высоким рН во избежание образования карбонатов. Необходимо учитывать и молекулярную массу инертного газа в сравнении с воздухом (М.М. 29), которая составляет у азота 28, аргона – 40, углекислого газа – 46.
Очевидно, что азот легче воздуха и будет быстрее испаряться из ампул, поэтому реже других газов используется в производстве.
