- •1. Основные положения мкт. Кол-во вещества. Число Авогадро. Молярная масса. Диффузия. Броуновское движение. Силы взаимодействия между молекулами.
- •2. Идеальный газ. Давление газа. Единицы давления. Манометр, барометр. Среднее значение квадрата скорости молекул. Основное уравнение мкт. Связь давления со средней кинетической энергией.
- •4. Макроскопические и микроскопические параметры. Уравнение состояния идеального газа. Универсальная газовая постоянная. Изотермический, изобарный, изохорный процесс. Аномальный свойства воды.
- •6. Взаимные превращения жидкостей и газов. Насыщенный пар. Испарение и конденсация. Кипение. Влажность воздуха. Психрометр. Фазовая диаграмма воды. Критическая и тройная точки воды.
- •7. Процессы теплопередачи. Теплопроводность, конвекция, излучение.
- •8. Вязкость (внутреннее трение). Уравнение Ньютона. Коэффициент вязкости.
- •9. Поверхностное натяжение. Коэффициент поверхностного натяжения. Смачивание и несмачивание. Капиллярные явления. Формула Лапласса.
- •10. Внутренняя энергия идеального одноатомного газа. Зависимость энергии от макроскопических параметров. Число степеней свободы. Внутренняя энергия многоатомного газа.
- •11. Работа в термодинамике. Изменение внутренней энергии при совершении работы. Геометрическое истолкование работы.
- •12. Количество теплоты. Теплоёмкость идеального газа. Удельная теплоемкость вещества. Молярная теплоемкость. Удельная теплоемкость парообразования, плавления. Изменение внутренней энергии.
- •13. Первый закон термодинамики. Его применение к изопроцессам. Теплоемкость в изобарном и изохорном процессе. Формулы Майера. Физический смысл газовой постоянной.
- •14. Адиабатический процесс. Уравнение Пуассона. Отношение теплоёмкостей в процессах с постоянным давление и постоянным объемом.
- •15. Необратимость процессов в природе. Второй закон термодинамики. Статистическое истолкование необратимости процессов в природе.
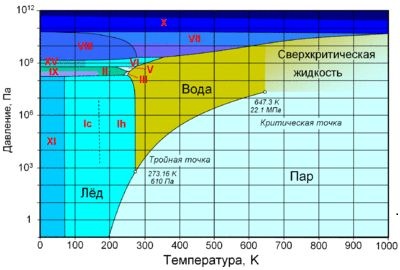
6. Взаимные превращения жидкостей и газов. Насыщенный пар. Испарение и конденсация. Кипение. Влажность воздуха. Психрометр. Фазовая диаграмма воды. Критическая и тройная точки воды.
Между жидкостью и паром, находящимся над ней может существовать динамическое равновесие, при котором число молекул, покидающих жидкость за некоторое время, равно числу молекул, возвращающихся их пара в жидкость за то же время. Пар, находящийся в равновесии со своей жидкостью называют насыщенным. Давление насыщенного пара не зависит от объема и определяется только темературой.
Жидкость кипит при температуре, при которой давление насыщенного пара в пузырьках становится равным давлению в жидкости. Чем больше внешнее давление, тем выше температура кипения
С увеличением температуры плотность насыщенного пара растет, а плотность жидкости уменьшается. При температуре, называемой критической, исчезают различия между жидкостью и ее насыщенным паром. Их плотности становятся одинаковыми. Давление, которое производил бы водяной пар, если бы все остальные газы отсутствовали, называют парциальным давлением водяного пара.
Кипение - это интенсивное парообразование, которое происходит при нагревании жидкости не только с поверхности, но и внутри неё.
Психро́метр — прибор для измерения влажности воздуха и его температуры.
Скорость испарения влаги увеличивается по мере уменьшения относительной влажности воздуха. Испарение влаги, в свою очередь вызывает охлаждение объекта, с которого влага испаряется. По мере охлаждения влажного объекта уменьшается и скорость испарения влаги до тех пор пока при некоторой температуре не будет достигнуто динамическое равновесие - количество испарившейся влаги сравняется с количеством конденсирующейся. Таким образом температура влажного объекта (например термометра, обёрнутого во влажную ткань) даёт информацию об относительной влажности воздуха. Простейший психрометр состоит из двух спиртовых термометров, один - обычный сухой термометр, а второй имеет устройство увлажнения. Термометры имеют градуировку с ценой деления 0,1-0,5 градуса. Термодатчик влажного термометра обернут хлопчатобумажной тканью, которая находится в сосуде с водой. Вследствие испарения влаги, увлажнённый термометр охлаждается. Для определения относительной влажности снимают показания с сухого и влажного термометров, а далее используют Психрометрическую таблицу. Обычно входными величинами в Психрометрической таблице являются показания сухого термометра и разница температур сухого и влажного термометров.
Относительная влажность — это отношение плотности водяного пара, содержащегося в воздухе, к плотности насыщенного пара при данной температуре, выраженное в процентах.
Тройная точка воды - строго определенные значения температуры и давления, при которых вода может одновременно существовать в твердом, жидком и газообразном состояниях.
Критическая точка – сочетание значений температуры и давления, при которых исчезает различие в свойствах жидкой и газообразной фаз вещества. Критическая точка для воды достигается с большим трудом при температуре 374,2° С и давлении 21,4 МПа.
Фа́зовая диагра́мма воды — графическое отображение равновесного состояния фаз воды (жидкости, водяного пара и различных модификаций льда). Строится в системе координат температура—давление.