
- •1 Общая характеристика и классификация ионитов
- •Неорганические иониты
- •1.2 Органические иониты
- •1.3 Маркирование ионитов
- •2 Применение ионитов
- •3 Аппаратурное оформление процесса ионного обмена
- •3.1 Аппараты с плотным слоем ионита периодического действия
- •4 Физико-химические свойства ионитов
- •4.1 Процесс обмена ионов
- •4.2 Кислотно-основные свойства ионитов
- •5 Регенерация ионитов
- •6 Технологический расчет
- •Список исаользованной литературы
СОДЕРЖАНИЕ
-
Введение
4
1 Общая характеристика и классификация ионитов
6
1.1 Неорганические иониты
7
1.2 Органические иониты
9
1.3 Маркирование ионитов
10
2 Применение ионитов
12
3 Аппаратурное оформление процесса ионного обмена
24
3.1 Аппараты с плотным слоем ионита периодического действия
26
3.2 Аппараты непрерывного действия
31
4 Физико-химические свойства ионитов
34
4.1 Процесс обмена ионов
34
4.2 Кислотно-основные свойства ионитов
35
5 Регенерация ионитов
6 Технологический расчет
36
39
Заключение
43
Список использованной литературы
44
Введение
Сегодня мир ионитов, иначе ионообменных веществ и материалов, велик и многообразен, а ионообменный процесс быстро и всесторонне входит в различные сферы человеческой деятельности. Наряду с ректификацией, экстракцией, абсорбцией и адсорбцией он стал типовым процессом химической технологии, занимая ведущее положение во многих отраслях промышленного производства. Все большее народнохозяйственное значение приобретают процессы ионного обмена в связи с внедрением в промышленную практику замкнутых технологических схем и комплексного использования сырья.
В данной работе большое внимание при изложении материала уделено современным вопросам химии ионитов, классификации и методу инженерного расчета ионообменного реактора.
Ионообменный метод, в ряде промышленных областей жизненно необходим, например, в гидрометаллургии редких и цветных металлов. При этом представляется возможность полного извлечения всех ценных компонентов из перерабатываемого сырья. Этот метод дает возможность улавливать цветные и редкие металлы из промышленных сточных вод гидрометаллургических производств, и цехов металлопокрытий. В результате сохраняется много ценных металлов, а сбрасываемые воды перестают отравлять природные водоемы.
В ряде других областей промышленности — химической, фармацевтической, пищевой и др. — ионообменные смолы дают возможность более рационально перестроить технологический процесс.
Очистка сточных вод, растворов и газов является важной составной частью комплекса мероприятий по снижению масштабов и темпов отрицательного воздействия хозяйственной деятельности людей на окружающую среду.
На фоне антропогенного рассеивания химических элементов в окружающую среду и попадания их в водоемы сорбционная технология получения металлов и других элементов из природных вод имеет большое значение.
Формирование состава сточных вод и газов происходит обычно за счет примесей, характерных для данного производства. Следовательно, при правильном выборе регенерирующего агента извлекаемые примеси могут быть возвращены в производство. Это обстоятельство позволяет решить проблему утилизации регенерационных растворов.
1 Общая характеристика и классификация ионитов
Иониты в обычном понимании – это твердые, зернистые, порошкообразные, формованные или волокнистые, механически прочные химически устойчивые, нерастворимые вещества, содержащие в своем составе функциональные (ионогенные) группы, способные к ионизации и обмену ионами с электролитами. При ионизации функциональных групп образуются две разновидности ионов:
1) фиксированные ионы, закрепленные на каркасе (матрице) ионита и не способные покинуть фазу ионита и перейти в раствор;
2) противоионы (обменные ионы), эквивалентно равные фиксированным ионам, но противоположные им по знаку, способные перейти во внешний раствор в обмен на строго эквивалентное количество других ионов того же знака, поступающие в ионит из внешнего раствора (обменных ионов раствора).
Ионит можно условно подразделить на три составные части: матрица, фиксированные ионы и противоионы (рис. 1).
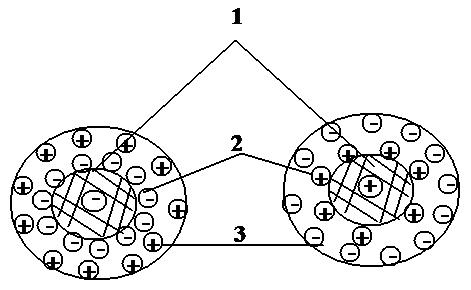
Рисунок 1 – Строение ионита:
1 – матрица; 2 – фиксированные ионы; 3 – противоионы.
По природе матрицы иониты подразделяют на неорганические (минеральные) и органические, природные и искусственные (синтетические).
К неорганическим природным ионитам относятся природные цеолиты, глинистые минералы (алюмосиликаты), бентонитовые глины, глауконит, вермикулит, полевые шпаты, слюда, оксиды, фосфаты и силикаты металлов (титана, кальция, циркония и др.) и природообразующие, рудные минералы переменного состава.
К неорганическим искусственным ионитам относятся синтетические цеолиты, труднорастворимые соли гетерополикислот с общей формулой Me3XY12O40·nH2O (где X = P, As, Sb, Si; Y = Mo, W, Me - металл), ферроцианиды, фосфаты, гидроксиды, оксиды, сульфиды металлов (циркония, алюминия, железа, титана, никеля и др.).
К органическим природным ионообменным материалам относятся каменные и бурые угли, торф, целлюлоза и др.
Широкое применение нашли синтетические органические иониты на основе высокомолекулярных органических соединений направленного синтеза, обладающие постоянством состава, высокой способностью к обмену ионами, химической устойчивостью и механической прочностью, с чрезвычайно широкими возможностями практического применения.
В зависимости от знака заряда противоионов различают: катиониты – ионы, способные к обмену катионами; анионы – иониты, способные к обмену анионами, и амфолиты (амфотерные полиэлектролиты) – ионы, способные к обмену как катионами, так и анионами, в зависимости от условий среды.
В зависимости от природы противоионов различают многочисленные ионные формы ионитов. Например, катиониты могут находится в водородной (Н-форма), солевой (натриевая, кальциевая и т.д.) и смешанной формах, аниониты – в гидроксильной (ОН-форма), солевой (хлоридная, сульфатная, и др.) и смешанной формах. Для полиамфолитов различаются водородно-гидроксильная, водородно-солевая, гидроксильно-солевая и солевая формы.
Неорганические иониты
Большинство известных неорганических ионитов проявляет катионообменные свойства. Наиболее важными представителями природных неорганических катионов являются цеолиты и глинистые материалы. Цеолиты – алюмосиликаты щелочных и щелочноземельных металлов с общей формулой Me2/nO∙Al2O3∙XSiO2∙YH2O, где Ме – катион щелочного металла, а n – его валентность.
Большинство цеолитов имеет трехмерную сетчатую структуру в виде жесткой кристаллической решетки (алюмокремне-кислородный каркас, образованный тетраэдрами SiO4 и Al4) со значительными расстояниями между углами решетки. Имеются цеолиты со слоистой и волокнистой структурой. Часть ионов Si4+ в решетке изоморфно замещены ионами Al3+, что создает избыток отрицательного заряда решетки, нейтрализуемый подвижными катионами натрия, калия, кальция, бария, стронция, магния, играющих роль противоиона. Цеолиты обладают высокими избирательными свойствами по отношению к крупным катионам щелочных (рубидий, цезий), некоторых щелочноземельных (стронций) и тяжелых (свинец, ртуть, серебро, кадмий, цинк и др.) металлов.
Наличие в полимерном каркасе цеолитов системы каналов и полостей с окнами строго определенного размера, образованными из кислородных колец, обусловливает способность цеолитов к молекулярной (объемной) сорбции воды, газов, и органических жидкостей. В обычных температурных условиях полости цеолитов заполнены молекулами воды, которые, ориентируясь вокруг обменных катионов, за счет водородных связей образуют аквакомплексы, через которые катионы осуществляют ионную связь с отрицательно заряженным каркасом цеолита. Катионы и молекулы воды в полостях цеолита образуют сильно концентрированный «цеолитный раствор». Если удалить цеолитную воду, нагреванием или продувкой горячим газом, то цеолиты могут быть использованы как сорбенты.
Решетка глинистых минералов состоит из слоев кремнекислородных тетраэдров и алюмокислородных октаэдров, силами межмолекулярного притяжения. Глинистые минералы высокодисперсные, имеют развитую поверхность и являются хорошими сорбентами (особенно для полярных веществ). Состав, особенности и физико–химические свойства глинистых минералов и цеолитов рассмотрены в работах [1,2,3].
Среди многочисленных синтетических неорганических ионитов кроме синтетических цеолитов наиболее перспективными для очистки сточных вод и растворов следующие катиониты:
1) гранулированные методом замораживания труднорастворимые фосфаты металлов, образующих многозарядные ионы (циркония, титана, хрома, железа, тория, сурьмы и т.д.). Цирконилфосфат (ZrO)m∙(H2PO4)n с отличающейся высокой емкостью обмена, термической и радиационной стойкостью. Устойчив в концентрированных кислотах и солевых растворах, сохраняет в них высокую ионообменную емкость и избирательность. Цирконилфосфат может быть использован для извлечения сильнокислых и сильноминерализованных радиоактивных растворов, долгоживущего изотопа 137Cs, для разделения продуктов радиоактивного распада урана в атомных реакторах: 89Sr - 137Cs, 89Sr – 144Cs, 90Sr – 90U; для отделения 95Nb и 95Zr от 106Ru; для извлечения ионов таллия из растворов в производстве и при использовании солей талия.
2) нерастворимые сульфиды и гидросульфиды тяжелых металлов. Например, очистка никелевых электролитов от примесей ионов меди, олова, свинца, кадмия, мышьяка, сурьмы, висмута с помощью нерастворимого сульфида никеля, от примесей железа (II) и кобальта (II) c помощью гидроксидов никеля в сочетании с анионитом АВ – 17 на конечной стадии очистки.
