
- •Глава 1. Предмет и значение аналитической химии 6
- •Глава 2. Теоретические основы аналитической химии 12
- •Глава 3. Качественный анализ 31
- •Глава 4. Количественный анализ 66
- •Введение
- •Глава 1. Предмет и значение аналитической химии
- •1.1. Краткий очерк о развитии аналитической химии
- •Глава 2. Теоретические основы аналитической химии
- •2.1. Химическое равновесие в гомогенной системе. Закон действия масс.
- •2.2. Протолитическая теория кислот и оснований
- •2.3. Степень электролитической диссоциации
- •2.4. Константа диссоциации слабого электролита
- •2.5. Коэффициент активности и ионная сила
- •2.6. Диссоциация воды. Водородный и гидроксильный показатели.
- •2.7. Действие одноименных ионов. Буферные растворы.
- •2.7. Гидролиз солей
- •2.8. Произведение растворимости. Произведение активностей ионов
- •Вопросы для самопроверки
- •Глава 3. Качественный анализ
- •3.1. Особенности аналитических реакций и способы их выполнения
- •3.2. Лабораторное оборудование и техника выполнения качественного анализа
- •3.3. Техника выполнения реакций
- •3.4. Методика выполнения основных операций в полумикроанализе
- •3.5. Реакции обнаружения катионов
- •Кислотно-щелочная классификация катионов
- •3.5.1. Первая группа катионов
- •Реакции ионов серебра
- •1. Реакция с хлороводородной кислотой и ее солями.
- •2. Реакция с гидроксидами щелочных металлов и аммиаком.
- •3. Реакция с хроматом калия k2CrO4 и дихроматом калия k2Cr2o7.
- •4. Реакция с ki.
- •3.5.2. Вторая группа катионов
- •Реакции ионов кальция
- •Реакции ионов бария
- •1. Реакции с серной кислотой и ее солями.
- •2. Реакции с хроматом калия k2CrO4 и дихроматом калия k2Cr2o7.
- •3. Реакция с оксалатом аммония (nh4)2c2o4.
- •3.5.3. Третья группа катионов
- •Реакции ионов хрома (III)
- •4. Окисление хрома(III) в кислой среде.
- •3.5.4. Четвертая группа катионов
- •Реакции ионов магния
- •4. Капельная реакция Тананаева.
- •Реакции ионов железа(II)
- •Реакции ионов железа(III)
- •3.5.5.Пятая группа катионов
- •Реакции ионов меди
- •3.5.6. Шестая группа катионов
- •Реакции ионов калия
- •Реакции ионов натрия
- •1.Реакция с дигидростильбатом калия kh2SbO4:
- •Реакции ионов аммония
- •Особенности анализа катионов VI группы
- •3.6. Реакции обнаружения анионов
- •Классификация анионов
- •3.6.1. Первая группа анионов
- •Реакции карбонат-ионов
- •2. Реакция с солями бария:
- •Реакции сульфат-ионов
- •Реакции фосфат-ионов
- •3.6.2.Вторая группа анионов
- •Реакции хлорид-ионов
- •3. Реакция с нитратом свинца:
- •3.6.3. Третья группа анионов
- •Реакции нитрат-ионов
- •3.7. Лабораторные работы по качественному анализу Работа 1 Дробное определение катионов:
- •Работа 2
- •Глава 4. Количественный анализ
- •4.1. Выполнение измерений, представление и обработка результатов химического анализа
- •4.1.1. Измерение аналитического сигнала
- •4.1.2 Погрешность методов анализа
- •4.1.3. Обработка результатов методом математической статистики
- •4.2. Гравиметрические методы анализа
- •Требования к осаждаемой форме
- •Требования к весовой форме
- •Требования к осадителю
- •Расчет количества осадителя
- •Образование осадков и их свойства
- •Фильтрование
- •Вычисления в гравиметрическом анализе
- •Вопросы и задачи для самостоятельной подготовки
- •4.3. Титриметрический анализ
- •Классификация титриметрических методов анализа
- •4.3.1. Способы выражения концентрации растворов
- •4.3.2. Техника работы
- •Растворы, применяемые в титриметрии
- •4.3.3. Расчеты в титриметрических методах анализа
- •Коэффициент поправки
- •4.3.4. Метод кислотно-основного титрования
- •Работа 1. Стандартизация раствора хлороводородной кислоты по тетраборату натрия
- •Работа 2. Определение устранимой жесткости (щелочности) воды
- •Работа 3. Определение содержания гидроксида натрия
- •Работа 4. Определение содержания хлороводородной кислоты
- •Вопросы для самостоятельной подготовки
- •4.3.5. Комплексонометрическое титрование
- •Работа 5. Определение общей жесткости воды
- •Работа 6. Определение кальциевой и магниевой жесткости воды
- •Работа 7. Определение содержания меди
- •Работа 8. Определение содержания железа (III)
- •Вопросы для самостоятельной подготовки
- •4.3.6. Окислительно-восстановительное титрование
- •Перманганатометрия
- •Работа 9. Определение содержания железа (II)
- •Вопросы для самостоятельной подготовки
- •4.4. Физико-химические методы анализа
- •Спектроскопические методы анализа
- •Электрохимические методы анализа
- •Методы хроматографического анализа
- •Важнейшие физико-химические методы анализа
- •Вопросы для самостоятельной подготовки
- •4.5. Решение расчетных задач Титриметрические методы анализа
- •Примеры решения задач на вычисление рН растворов
- •4.6. Задачи для самостоятельного решения
- •Приложение Содержание курса «Химия (аналитическая)» для студентов геологического факультета
- •Раздел 1. Теоретические основы аналитической химии
- •Тема 2. Качественный анализ
- •Тема 3. Количественный анализ
- •Литература
- •614990. Пермь, ул. Букирева, 15
4.3.2. Техника работы
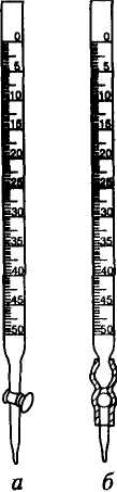
Рис. 9. Бюретки
М
Рис.
8. Мерные колбы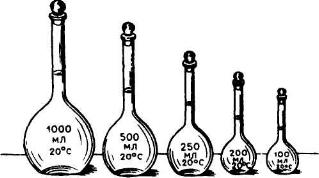
колбы над меткой не должно быть капель жидкости, внутренние стенки колбы должны быть чистыми, и жидкость должна смачивать их ровным слоем.
Нагревать мерные колбы нельзя, иначе может произойти деформация стекла, что повлечет за собой изменение их вместимости. Мерные колбы различаются по вместимости: 25; 50; 100; 200; 250; 500 и 1000 мл. Единицей измерения является литр (л) — объем, занимаемый 1 кг воды при 3,98°С и нормальном атмосферном давлении; тысячная доля литра — миллилитр (мл).
Бюретки. Бюретки позволяют отмерять нужные объемы жидкости и калиброваны на выливание. В зависимости от назначения бюретки бывают разных размеров и разных конструкций. Обычные лабораторные бюретки представляют собой градуированные цилиндрические трубки с суженным концом, который снабжен специальным краном, или соединен резиновой трубкой с оттянутой стеклянной трубочкой (рис. 9). Вместимость бюреток бывает разной (обычно от 10 до 100 мл). Их калибруют в миллилитрах и их десятых долях (т. е. каждое маленькое деление бюретки соответствует 0,1 мл). Нулевое деление находится в верхней части бюретки.Перед работой бюретки следует тщательно вымыть моющими смесями и водой так, чтобы жидкость стекала с внутренних стенок ровным слоем, не оставляя капель. Перед работой бюретку нужно три раза ополоснуть раствором, который будет в нее налит, этим раствором должна быть промыта вся внутренняя поверхность, чтобы при последующем заполнении бюретки раствором он не менял свою концентрацию за счет разбавления водой, смачивающей стенки бюретки. После ополаскивания бюретки ее закрепляют строго вертикально в штативе и заполняют раствором до уровня, превышающего нулевую отметку на 2-3 см. Нужно проследить, чтобы вся бюретка целиком до самого кончика была заполнена раствором. В бюретке не должно быть пузырьков воздуха, особенно часто они возникают в суженной ее части. Для удаления пузырьков воздуха из бюреток (рис. 9а) обычно дают вытечь части раствора сильной струей, для бюреток другого типа (рис. 9б) отгибают кверху стеклянную трубочку и выпускают некоторую часть жидкости. После этого вновь наливают раствор выше нулевой метки и устанавливают исходный нулевой уровень раствора. Поместив уровень нулевой отметки на уровень глаз, выпускают жидкость из бюретки до тех пор, пока край ее нижнего мениска не коснется отметки 0,00 мл.
В процессе титрования выливать жидкость из бюретки нужно не очень быстро; после окончания титрования нужно подождать 30 с, прежде чем производить отсчет объема раствора, вылитого из бюретки. Это делается для того, чтобы жидкость, оставшаяся на стенках бюретки, успела стечь. Отсчет по бюретке проводят всегда с точностью до 0,01 мл. Перед каждым титрованием уровень раствора нужно доводить до нулевого положения, т. е. пользоваться всегда одной и той же частью бюретки. Важен объем жидкости, идущей на титрование. Он должен быть и не слишком мал, и не слишком велик. Он не должен превышать вместимость бюретки и должен составлять примерно от 1/3 по 2/3 ее вместимости.
П
Рис. 10. Обычные
пипетки:
а – мерная; б
– градуированная;
в – серологическая;
г – Оствальда-
Фолина; д
– "ламбда"
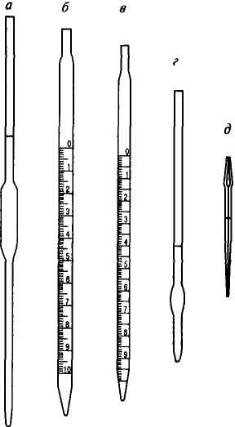
Пипетку тщательно моют моющими смесями, затем ее многократно ополаскивают сначала водопроводной, а затем дистиллированной водой. Убедившись в том, что вода смачивает внутренние стенки ровным слоем, не оставляя капель (в противном случае мытье пипетки повторяют), всю внутреннюю поверхность пипетки ополаскивают тем раствором, который предполагается отбирать пипеткой. Затем берут пипетку большим и средним пальцами правой руки и погружают ее нижний конец глубоко в раствор, с помощью резиновой груши наполняют ее раствором так, чтобы уровень жидкости в ней оказался выше метки примерно на 2 см. После этого быстро зажимают верхнее отверстие пипетки указательным пальцем. Затем слегка приоткрывают отверстие, чтобы стекла лишняя жидкость и нижний край мениска коснулся метки (при этом метка должна находиться на уровне глаз). Вновь плотно закрывают отверстие и переносят пипетку в заранее подготовленный сосуд (чаще всего в колбу для титрования). Держа пипетку вертикально, отнимают от ее отверстия палец и дают жидкости свободно вытекать; когда вся жидкость вытечет, прикасаются кончиком пипетки к стенке сосуда и ждут 20 с. Затем вынимают пипетку и не обращают внимания на небольшое количество раствора, оставшегося в ее носике: калибрование пипеток рассчитано именно на такой способ выливания.
Выдувание оставшейся в пипетке капли раствора недопустимо, так как в этом случае невозможно добиться совпадения результатов измерения объемов.
Индикаторы. Для визуального определения точки эквивалентности (ТЭ) по изменению цвета раствора применяют индикаторы. Область значений рН, в которой происходит заметное изменение окраски индикатора называют областью перехода индикатора. В ходе титрования титрант ("рабочий раствор") приливают до отчетливого изменения окраски индикатора. Окраске индикатора, при которой заканчивают титрование, отвечает определенное значение рН, лежащее внутри области перехода. Величину рН, при которой наблюдается наиболее резкое изменение окраски индикатора, до которой титруют раствор с данным индикатором, называют показателем титрования этого индикатора (pT).
