
- •Глава 1. Предмет и значение аналитической химии 6
- •Глава 2. Теоретические основы аналитической химии 12
- •Глава 3. Качественный анализ 31
- •Глава 4. Количественный анализ 66
- •Введение
- •Глава 1. Предмет и значение аналитической химии
- •1.1. Краткий очерк о развитии аналитической химии
- •Глава 2. Теоретические основы аналитической химии
- •2.1. Химическое равновесие в гомогенной системе. Закон действия масс.
- •2.2. Протолитическая теория кислот и оснований
- •2.3. Степень электролитической диссоциации
- •2.4. Константа диссоциации слабого электролита
- •2.5. Коэффициент активности и ионная сила
- •2.6. Диссоциация воды. Водородный и гидроксильный показатели.
- •2.7. Действие одноименных ионов. Буферные растворы.
- •2.7. Гидролиз солей
- •2.8. Произведение растворимости. Произведение активностей ионов
- •Вопросы для самопроверки
- •Глава 3. Качественный анализ
- •3.1. Особенности аналитических реакций и способы их выполнения
- •3.2. Лабораторное оборудование и техника выполнения качественного анализа
- •3.3. Техника выполнения реакций
- •3.4. Методика выполнения основных операций в полумикроанализе
- •3.5. Реакции обнаружения катионов
- •Кислотно-щелочная классификация катионов
- •3.5.1. Первая группа катионов
- •Реакции ионов серебра
- •1. Реакция с хлороводородной кислотой и ее солями.
- •2. Реакция с гидроксидами щелочных металлов и аммиаком.
- •3. Реакция с хроматом калия k2CrO4 и дихроматом калия k2Cr2o7.
- •4. Реакция с ki.
- •3.5.2. Вторая группа катионов
- •Реакции ионов кальция
- •Реакции ионов бария
- •1. Реакции с серной кислотой и ее солями.
- •2. Реакции с хроматом калия k2CrO4 и дихроматом калия k2Cr2o7.
- •3. Реакция с оксалатом аммония (nh4)2c2o4.
- •3.5.3. Третья группа катионов
- •Реакции ионов хрома (III)
- •4. Окисление хрома(III) в кислой среде.
- •3.5.4. Четвертая группа катионов
- •Реакции ионов магния
- •4. Капельная реакция Тананаева.
- •Реакции ионов железа(II)
- •Реакции ионов железа(III)
- •3.5.5.Пятая группа катионов
- •Реакции ионов меди
- •3.5.6. Шестая группа катионов
- •Реакции ионов калия
- •Реакции ионов натрия
- •1.Реакция с дигидростильбатом калия kh2SbO4:
- •Реакции ионов аммония
- •Особенности анализа катионов VI группы
- •3.6. Реакции обнаружения анионов
- •Классификация анионов
- •3.6.1. Первая группа анионов
- •Реакции карбонат-ионов
- •2. Реакция с солями бария:
- •Реакции сульфат-ионов
- •Реакции фосфат-ионов
- •3.6.2.Вторая группа анионов
- •Реакции хлорид-ионов
- •3. Реакция с нитратом свинца:
- •3.6.3. Третья группа анионов
- •Реакции нитрат-ионов
- •3.7. Лабораторные работы по качественному анализу Работа 1 Дробное определение катионов:
- •Работа 2
- •Глава 4. Количественный анализ
- •4.1. Выполнение измерений, представление и обработка результатов химического анализа
- •4.1.1. Измерение аналитического сигнала
- •4.1.2 Погрешность методов анализа
- •4.1.3. Обработка результатов методом математической статистики
- •4.2. Гравиметрические методы анализа
- •Требования к осаждаемой форме
- •Требования к весовой форме
- •Требования к осадителю
- •Расчет количества осадителя
- •Образование осадков и их свойства
- •Фильтрование
- •Вычисления в гравиметрическом анализе
- •Вопросы и задачи для самостоятельной подготовки
- •4.3. Титриметрический анализ
- •Классификация титриметрических методов анализа
- •4.3.1. Способы выражения концентрации растворов
- •4.3.2. Техника работы
- •Растворы, применяемые в титриметрии
- •4.3.3. Расчеты в титриметрических методах анализа
- •Коэффициент поправки
- •4.3.4. Метод кислотно-основного титрования
- •Работа 1. Стандартизация раствора хлороводородной кислоты по тетраборату натрия
- •Работа 2. Определение устранимой жесткости (щелочности) воды
- •Работа 3. Определение содержания гидроксида натрия
- •Работа 4. Определение содержания хлороводородной кислоты
- •Вопросы для самостоятельной подготовки
- •4.3.5. Комплексонометрическое титрование
- •Работа 5. Определение общей жесткости воды
- •Работа 6. Определение кальциевой и магниевой жесткости воды
- •Работа 7. Определение содержания меди
- •Работа 8. Определение содержания железа (III)
- •Вопросы для самостоятельной подготовки
- •4.3.6. Окислительно-восстановительное титрование
- •Перманганатометрия
- •Работа 9. Определение содержания железа (II)
- •Вопросы для самостоятельной подготовки
- •4.4. Физико-химические методы анализа
- •Спектроскопические методы анализа
- •Электрохимические методы анализа
- •Методы хроматографического анализа
- •Важнейшие физико-химические методы анализа
- •Вопросы для самостоятельной подготовки
- •4.5. Решение расчетных задач Титриметрические методы анализа
- •Примеры решения задач на вычисление рН растворов
- •4.6. Задачи для самостоятельного решения
- •Приложение Содержание курса «Химия (аналитическая)» для студентов геологического факультета
- •Раздел 1. Теоретические основы аналитической химии
- •Тема 2. Качественный анализ
- •Тема 3. Количественный анализ
- •Литература
- •614990. Пермь, ул. Букирева, 15
4.1.3. Обработка результатов методом математической статистики
Цель всех аналитических исследований – нахождение результата, наиболее близкого к истинному содержанию в пробе.
Общую погрешность метода можно оценить только с привлечением методов математической статистики. Эти методы исходят из идеализированного представления о бесконечно большом числе измерений. Исследователь же имеет дело с небольшим числом измерений (n<20), они называются выборочной совокупностью или выборкой. При оценке результатов анализа часто пользуются средним арифметическим значением. Прежде чем рассчитать среднее арифметическое значение результатов, они должны быть оценены на предмет выявления промахов, т. е. грубых отклонений. Нельзя без предварительной оценки отбросить кажущиеся неподходящими значения. Промахи или грубые отклонения устанавливаются по "размаху варьирования". Размах варьирования – это разница между двумя крайними значениями – максимальным (хmax) и минимальным (хmin). Далее вычисляют Q критерий, который определяется отношением:
![]() ,
,
где х1 – подозрительно выделяющееся значение;
х2 – значение, ближайшее по величине к подозрительному.
Вычисленную величину Q сопоставляют с табличным значением (таблицы обычно приведены в учебниках). Наличие грубого промаха доказано, если Q>Qтабл при данном числе определений n и выбранной доверительной вероятности P.
Доверительная вероятность (Р) – это соответствие экспериментального результата истинной величине и обычно принимается равной 95% или 90%.
При систематической обработке данных рассчитывают следующие основные характеристики выборочной совокупности.
1. Среднее арифметическое для выборки из n результатов

2. Дисперсию, характеризующую рассеяние результатов относительно среднего

3. Стандартное отклонение \
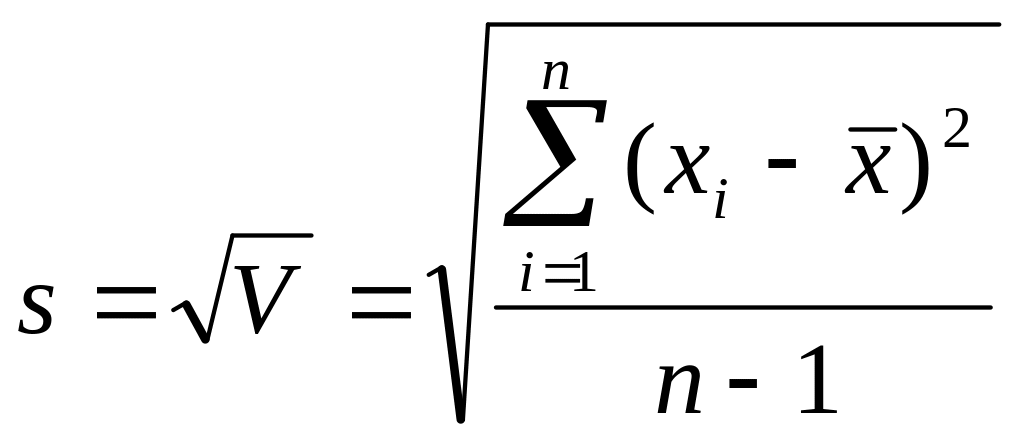
4. Относительное стандартное отклонение
![]()
Дисперсия, стандартное отклонение и относительное стандартное отклонение – характеризуют воспроизводимость результатов химического анализа, то есть отражают случайные ошибки измерений.
5. Доверительный интервал.
Для
ограниченного числа измерений истинное
значение определяемой величины находится
в пределах определенного интервала от
среднего арифметического
![]() ,
т.е. в пределах
,
т.е. в пределах
![]() .
Этот интервал называют доверительным.
Обычно при обработке данных химического
анализа его определяют для заданной
доверительной вероятности (при отсутствии
систематических погрешностей в этом
интервале с соответствующей вероятностью
находится истинное значение хист).
Этот интервал можно рассчитать, пользуясь
выражением
.
Этот интервал называют доверительным.
Обычно при обработке данных химического
анализа его определяют для заданной
доверительной вероятности (при отсутствии
систематических погрешностей в этом
интервале с соответствующей вероятностью
находится истинное значение хист).
Этот интервал можно рассчитать, пользуясь
выражением
![]()
где
tP,f
– коэффициент распределения
Стьюдента
(эта величина берется из справочных
таблиц); s
– стандартное
отклонение измеряемой величины,
рассчитанное для выборочной совокупности
из n
данных, а f
= n–1.
Доверительную вероятность Р
обычно
принимают равной 0,95, хотя в зависимости
от характера решаемой задачи ее можно
полагать равной 0,90, 0,99 или какой-либо
другой величине. Если известно истинное
значение хист,
то доверительный интервал (![]() )
характеризует как воспроизводимость
результатов химического анализа, так
и их правильность.
)
характеризует как воспроизводимость
результатов химического анализа, так
и их правильность.
Обработанные данные можно представить в виде таблицы, форма которой приведена ниже:
Таблица 3.
Представление экспериментальных данных
xi |
n |
|
V (s или sr |
|
|
|
|
|
|
|
|
