
- •Глава 1. Предмет и значение аналитической химии 6
- •Глава 2. Теоретические основы аналитической химии 12
- •Глава 3. Качественный анализ 31
- •Глава 4. Количественный анализ 66
- •Введение
- •Глава 1. Предмет и значение аналитической химии
- •1.1. Краткий очерк о развитии аналитической химии
- •Глава 2. Теоретические основы аналитической химии
- •2.1. Химическое равновесие в гомогенной системе. Закон действия масс.
- •2.2. Протолитическая теория кислот и оснований
- •2.3. Степень электролитической диссоциации
- •2.4. Константа диссоциации слабого электролита
- •2.5. Коэффициент активности и ионная сила
- •2.6. Диссоциация воды. Водородный и гидроксильный показатели.
- •2.7. Действие одноименных ионов. Буферные растворы.
- •2.7. Гидролиз солей
- •2.8. Произведение растворимости. Произведение активностей ионов
- •Вопросы для самопроверки
- •Глава 3. Качественный анализ
- •3.1. Особенности аналитических реакций и способы их выполнения
- •3.2. Лабораторное оборудование и техника выполнения качественного анализа
- •3.3. Техника выполнения реакций
- •3.4. Методика выполнения основных операций в полумикроанализе
- •3.5. Реакции обнаружения катионов
- •Кислотно-щелочная классификация катионов
- •3.5.1. Первая группа катионов
- •Реакции ионов серебра
- •1. Реакция с хлороводородной кислотой и ее солями.
- •2. Реакция с гидроксидами щелочных металлов и аммиаком.
- •3. Реакция с хроматом калия k2CrO4 и дихроматом калия k2Cr2o7.
- •4. Реакция с ki.
- •3.5.2. Вторая группа катионов
- •Реакции ионов кальция
- •Реакции ионов бария
- •1. Реакции с серной кислотой и ее солями.
- •2. Реакции с хроматом калия k2CrO4 и дихроматом калия k2Cr2o7.
- •3. Реакция с оксалатом аммония (nh4)2c2o4.
- •3.5.3. Третья группа катионов
- •Реакции ионов хрома (III)
- •4. Окисление хрома(III) в кислой среде.
- •3.5.4. Четвертая группа катионов
- •Реакции ионов магния
- •4. Капельная реакция Тананаева.
- •Реакции ионов железа(II)
- •Реакции ионов железа(III)
- •3.5.5.Пятая группа катионов
- •Реакции ионов меди
- •3.5.6. Шестая группа катионов
- •Реакции ионов калия
- •Реакции ионов натрия
- •1.Реакция с дигидростильбатом калия kh2SbO4:
- •Реакции ионов аммония
- •Особенности анализа катионов VI группы
- •3.6. Реакции обнаружения анионов
- •Классификация анионов
- •3.6.1. Первая группа анионов
- •Реакции карбонат-ионов
- •2. Реакция с солями бария:
- •Реакции сульфат-ионов
- •Реакции фосфат-ионов
- •3.6.2.Вторая группа анионов
- •Реакции хлорид-ионов
- •3. Реакция с нитратом свинца:
- •3.6.3. Третья группа анионов
- •Реакции нитрат-ионов
- •3.7. Лабораторные работы по качественному анализу Работа 1 Дробное определение катионов:
- •Работа 2
- •Глава 4. Количественный анализ
- •4.1. Выполнение измерений, представление и обработка результатов химического анализа
- •4.1.1. Измерение аналитического сигнала
- •4.1.2 Погрешность методов анализа
- •4.1.3. Обработка результатов методом математической статистики
- •4.2. Гравиметрические методы анализа
- •Требования к осаждаемой форме
- •Требования к весовой форме
- •Требования к осадителю
- •Расчет количества осадителя
- •Образование осадков и их свойства
- •Фильтрование
- •Вычисления в гравиметрическом анализе
- •Вопросы и задачи для самостоятельной подготовки
- •4.3. Титриметрический анализ
- •Классификация титриметрических методов анализа
- •4.3.1. Способы выражения концентрации растворов
- •4.3.2. Техника работы
- •Растворы, применяемые в титриметрии
- •4.3.3. Расчеты в титриметрических методах анализа
- •Коэффициент поправки
- •4.3.4. Метод кислотно-основного титрования
- •Работа 1. Стандартизация раствора хлороводородной кислоты по тетраборату натрия
- •Работа 2. Определение устранимой жесткости (щелочности) воды
- •Работа 3. Определение содержания гидроксида натрия
- •Работа 4. Определение содержания хлороводородной кислоты
- •Вопросы для самостоятельной подготовки
- •4.3.5. Комплексонометрическое титрование
- •Работа 5. Определение общей жесткости воды
- •Работа 6. Определение кальциевой и магниевой жесткости воды
- •Работа 7. Определение содержания меди
- •Работа 8. Определение содержания железа (III)
- •Вопросы для самостоятельной подготовки
- •4.3.6. Окислительно-восстановительное титрование
- •Перманганатометрия
- •Работа 9. Определение содержания железа (II)
- •Вопросы для самостоятельной подготовки
- •4.4. Физико-химические методы анализа
- •Спектроскопические методы анализа
- •Электрохимические методы анализа
- •Методы хроматографического анализа
- •Важнейшие физико-химические методы анализа
- •Вопросы для самостоятельной подготовки
- •4.5. Решение расчетных задач Титриметрические методы анализа
- •Примеры решения задач на вычисление рН растворов
- •4.6. Задачи для самостоятельного решения
- •Приложение Содержание курса «Химия (аналитическая)» для студентов геологического факультета
- •Раздел 1. Теоретические основы аналитической химии
- •Тема 2. Качественный анализ
- •Тема 3. Количественный анализ
- •Литература
- •614990. Пермь, ул. Букирева, 15
4. Капельная реакция Тананаева.
Выполнение определения. На полоску фильтровальной бумаги наносят каплю исследуемого раствора, 1 каплю фенолфталеина, 1 каплю раствора аммиака. Бумага окрасится в малиновый цвет. Бумагу осторожно подсушивают и окраска исчезает. Добавляют 1 каплю воды. При наличии Mg2+ снова появляется малиновое пятно за счет некоторой растворимости Mg(OH)2.
5. Органический реагент 8-оксихинолин в аммиачной среде образует устойчивое комплексное соединение с катионами магния – оксихинолят магния (Кнест = 4,7∙10–7), в виде осадка желто-зеленого цвета:
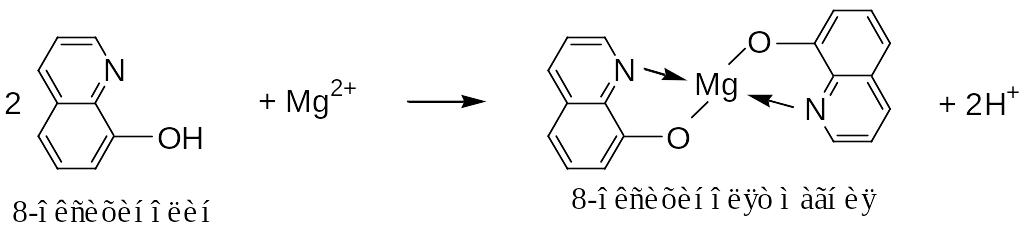
Чувствительность реакции – 0,25 мкг. Мешают обнаружению ионов магния с помощью данной реакции ионы Ca2+, Ba2+, Sr2+, которые предварительно осаждают сульфатом натрия.
Выполнение реакции. В пробирку к 3 каплям раствора соли магния добавьте равный объем водного раствора аммиака, перемешайте. Затем по каплям прилейте насыщенный раствор хлорида аммония до полного растворения образовавшегося осадка Mg(OH)2. К полученному раствору добавьте 3-4 капли 8-оксихинолина, наблюдая при этом образование зеленовато-желтого осадка.
Реакции ионов железа(II)
1. Гексацианоферрат (III) калия (красная кровяная соль) образует с ионами железа (II) синий осадок, называемый "турнбулевой синью":
3FeCl2 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2↓ + 6KCl.
"турнбулева синь"
Реакцию следует выполнять при рН 2-3, в более кислой среде происходит растворение осадка, в щелочных растворах – разложение реактива с выделением гидроксида железа. Мешает проведению реакции присутствие окислителей, окисляющих Fe2+в Fe3+или восстановителей, восстанавливающих [Fe(CN)6]3- в [Fe(CN)6]4-. Предел обнаружения железа – 0,02 мкг. Реакция специфична.
Выполнение реакции. К 1-2 каплям слабокислого раствора (рН 2-3), содержащего ионы железа (II), добавляют 1-2 капли раствора реагента. Образуется синий осадок. Ионы Fe3+ не мешают открытию Fe2+, так как не образуют осадка с K3[Fe(CN)6].
2. Раствор аммиака осаждает белый осадок гидроксида железа, однако осаждение не полное:
FeCl2 + 2NH4OH = Fe(OH)2↓ +2NH4Cl.
Пр![]() достаточно
велико, поэтому осадок растворяется в
солях аммония.
достаточно
велико, поэтому осадок растворяется в
солях аммония.
3. Едкие щелочи также осаждают гидроксид железа (II):
FeCl2 + 2NaOH = Fe(OH)2↓ +2NaCl.
Если осаждение вести без допуска воздуха, то выпадающий Fe(OH)2 представляет собой осадок белого цвета. В обычных условиях в результате частичного окисления осадок имеет грязновато-зеленый цвет.
Реакции ионов железа(III)
1. Гексацианоферрат (II) калия (желтая кровяная соль) образует с ионами железа (III) темно-синий осадок "берлинской лазури":
4FeCl3 + 3K4[Fe(CN)6]4- = Fe4[Fe(CN)6]3↓ + 12KCl.
При малых концентрациях Fe3+ раствор окрашивается в синий цвет. Осадок "берлинской лазури" растворяется в сильных кислотах и при добавлении избытка реагента. В щелочной среде происходит разложение "берлинской лазури" с образованием гидроксида железа (III). Предел обнаружения железа – 0,2 мкг. Мешают большие количества ионов металлов, которые дают окрашенные осадки с гексацианоферратом (II) калия, а также фториды и оксалаты, образующие устойчивые комплексы с Fe(III).
Выполнение реакции. К 1-2 каплям слабокислого раствора, содержащего ионы Fe(III) и имеющего рН 1-3, добавляют 1-2 капли раствора реагента. Наблюдают образование темно-синего осадка "берлинской лазури".
2. Тиоцианат аммония (калия) в слабокислых растворах образует с железом (III) комплексные соединения кроваво-красного цвета Fe(SCN)n(-n+3), где n=1-6. Комплексы Fe(SCN)3 и HFe(SCN)4 экстрагируются эфиром и изоамиловым спиртом. Предел обнаружения железа – 0,5 мкг. Мешают анионы, образующие с Fe(III) устойчивые комплексные соединения (фосфаты, фториды, оксалаты, арсенаты, цитраты, тартраты), а также нитрит-ионы, образующие с SCN- окрашенное в красный цвет соединение NOSCN.
Выполнение реакции. К 1-2 каплям раствора, содержащего ионы железа (III), добавляют каплю раствора NH4SCN. Появляется кроваво-красное окрашивание раствора. Добавляют несколько капель изоамилового спирта или эфира и встряхивают. Органическая фаза окрашивается в красный цвет.
3. Едкие щелочи и аммиак образуют с ионами железа(III) осадок гидроксида железа:
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl.
Осадок красно-бурого цвета, растворимый в кислотах и не растворимый в избытке щелочей (отличие от Al(OH)3 и Cr(OH)3). Гидроксид железа (III) нерастворим в солях аммония, в этом его отличие от Fe(OH)2.
