
- •Глава 1. Предмет и значение аналитической химии 6
- •Глава 2. Теоретические основы аналитической химии 12
- •Глава 3. Качественный анализ 31
- •Глава 4. Количественный анализ 66
- •Введение
- •Глава 1. Предмет и значение аналитической химии
- •1.1. Краткий очерк о развитии аналитической химии
- •Глава 2. Теоретические основы аналитической химии
- •2.1. Химическое равновесие в гомогенной системе. Закон действия масс.
- •2.2. Протолитическая теория кислот и оснований
- •2.3. Степень электролитической диссоциации
- •2.4. Константа диссоциации слабого электролита
- •2.5. Коэффициент активности и ионная сила
- •2.6. Диссоциация воды. Водородный и гидроксильный показатели.
- •2.7. Действие одноименных ионов. Буферные растворы.
- •2.7. Гидролиз солей
- •2.8. Произведение растворимости. Произведение активностей ионов
- •Вопросы для самопроверки
- •Глава 3. Качественный анализ
- •3.1. Особенности аналитических реакций и способы их выполнения
- •3.2. Лабораторное оборудование и техника выполнения качественного анализа
- •3.3. Техника выполнения реакций
- •3.4. Методика выполнения основных операций в полумикроанализе
- •3.5. Реакции обнаружения катионов
- •Кислотно-щелочная классификация катионов
- •3.5.1. Первая группа катионов
- •Реакции ионов серебра
- •1. Реакция с хлороводородной кислотой и ее солями.
- •2. Реакция с гидроксидами щелочных металлов и аммиаком.
- •3. Реакция с хроматом калия k2CrO4 и дихроматом калия k2Cr2o7.
- •4. Реакция с ki.
- •3.5.2. Вторая группа катионов
- •Реакции ионов кальция
- •Реакции ионов бария
- •1. Реакции с серной кислотой и ее солями.
- •2. Реакции с хроматом калия k2CrO4 и дихроматом калия k2Cr2o7.
- •3. Реакция с оксалатом аммония (nh4)2c2o4.
- •3.5.3. Третья группа катионов
- •Реакции ионов хрома (III)
- •4. Окисление хрома(III) в кислой среде.
- •3.5.4. Четвертая группа катионов
- •Реакции ионов магния
- •4. Капельная реакция Тананаева.
- •Реакции ионов железа(II)
- •Реакции ионов железа(III)
- •3.5.5.Пятая группа катионов
- •Реакции ионов меди
- •3.5.6. Шестая группа катионов
- •Реакции ионов калия
- •Реакции ионов натрия
- •1.Реакция с дигидростильбатом калия kh2SbO4:
- •Реакции ионов аммония
- •Особенности анализа катионов VI группы
- •3.6. Реакции обнаружения анионов
- •Классификация анионов
- •3.6.1. Первая группа анионов
- •Реакции карбонат-ионов
- •2. Реакция с солями бария:
- •Реакции сульфат-ионов
- •Реакции фосфат-ионов
- •3.6.2.Вторая группа анионов
- •Реакции хлорид-ионов
- •3. Реакция с нитратом свинца:
- •3.6.3. Третья группа анионов
- •Реакции нитрат-ионов
- •3.7. Лабораторные работы по качественному анализу Работа 1 Дробное определение катионов:
- •Работа 2
- •Глава 4. Количественный анализ
- •4.1. Выполнение измерений, представление и обработка результатов химического анализа
- •4.1.1. Измерение аналитического сигнала
- •4.1.2 Погрешность методов анализа
- •4.1.3. Обработка результатов методом математической статистики
- •4.2. Гравиметрические методы анализа
- •Требования к осаждаемой форме
- •Требования к весовой форме
- •Требования к осадителю
- •Расчет количества осадителя
- •Образование осадков и их свойства
- •Фильтрование
- •Вычисления в гравиметрическом анализе
- •Вопросы и задачи для самостоятельной подготовки
- •4.3. Титриметрический анализ
- •Классификация титриметрических методов анализа
- •4.3.1. Способы выражения концентрации растворов
- •4.3.2. Техника работы
- •Растворы, применяемые в титриметрии
- •4.3.3. Расчеты в титриметрических методах анализа
- •Коэффициент поправки
- •4.3.4. Метод кислотно-основного титрования
- •Работа 1. Стандартизация раствора хлороводородной кислоты по тетраборату натрия
- •Работа 2. Определение устранимой жесткости (щелочности) воды
- •Работа 3. Определение содержания гидроксида натрия
- •Работа 4. Определение содержания хлороводородной кислоты
- •Вопросы для самостоятельной подготовки
- •4.3.5. Комплексонометрическое титрование
- •Работа 5. Определение общей жесткости воды
- •Работа 6. Определение кальциевой и магниевой жесткости воды
- •Работа 7. Определение содержания меди
- •Работа 8. Определение содержания железа (III)
- •Вопросы для самостоятельной подготовки
- •4.3.6. Окислительно-восстановительное титрование
- •Перманганатометрия
- •Работа 9. Определение содержания железа (II)
- •Вопросы для самостоятельной подготовки
- •4.4. Физико-химические методы анализа
- •Спектроскопические методы анализа
- •Электрохимические методы анализа
- •Методы хроматографического анализа
- •Важнейшие физико-химические методы анализа
- •Вопросы для самостоятельной подготовки
- •4.5. Решение расчетных задач Титриметрические методы анализа
- •Примеры решения задач на вычисление рН растворов
- •4.6. Задачи для самостоятельного решения
- •Приложение Содержание курса «Химия (аналитическая)» для студентов геологического факультета
- •Раздел 1. Теоретические основы аналитической химии
- •Тема 2. Качественный анализ
- •Тема 3. Количественный анализ
- •Литература
- •614990. Пермь, ул. Букирева, 15
4. Окисление хрома(III) в кислой среде.
Окисление Cr3+ перманганатом калия в кислой среде протекает по уравнению:
Cr2(SO4)3 + 2KMnO4 + 5Н2О = К2Cr2О7 + 2H2MnO3↓ + 3H2SO4.
Из уравнения реакции видно, что продукт окисления в этом случае – не желтый ион CrO42-, а оранжевый ион Cr2O72-.
Выполнение реакции. В пробирку вносят 2-3 капли раствора соли Сr3+, 1 каплю 1М раствора H2SO4, 2-3 капли раствора KMnO4, подогревают на водяной бане, появляется оранжевое окрашивание дихромат-иона. После охлаждения раствора вносят в него 1-2 капли H2O2 и 6-8 капель амилового спирта или эфира. Тотчас же взбалтывают. Всплывающий наверх слой эфира окрашивается в синий цвет, вследствие образования надхромовой кислоты:
К2Cr2О7 + 4Н2O2 + H2SO4 2Н2CrO6 + K2SO4 + 3Н2О.
При проведении реакции без органического растворителя появляется быстро исчезающая синяя окраска надхромовой кислоты (либо ее ангидрида CrО5), легко разлагающейся в водном растворе.
3.5.4. Четвертая группа катионов
К четвертой аналитической группе относятся катионы Mg2+, Mn2+, Fe2+, Fe3+. Гидроксиды катионов IV группы нерастворимы в избытке щелочей и растворе аммиака. Все катионы образуют труднорастворимые фосфаты, оксалаты, сульфиды (кроме Mg2+), Mn(II), Fe(II), Fe(III) проявляют окислительно-восстановительные свойства. В водных растворах соли Fe(II) имеют бледно-зеленую окраску, Fe(III) – желтую, Mn(II) – бледно-розовую, а Mg - бесцветную окраску. Все соли катионов IV группы подвергаются гидролизу, особенно соли железа(III)
Реакции ионов магния
1. Гидрофосфат натрия образует с ионами магния в присутствии NH3 при рН 9 белый кристаллический осадок MgNH4PO4∙6Н2О:
MgCl2 +NaHPO4 + NH3 = MgNH4PO4↓ + 2NaCl.
При рН>10 могут образоваться Mg(OH)2 и Mg3(PO4)2. Рекомендуется к кислому анализируемому раствору прибавлять раствор NH3 до рН ~9. Из-за образования NH4C1 рН раствора поддерживается постоянным.
Осадок растворяется в сильных кислотах и в уксусной килоте:
MgNH4PO4 + 3HCl = H3PO4 + MgCl2 + NH4Cl;
MgNH4PO4 + 2СН3СООН = Mg(CH3COO)2 + NH4H2PO4 .
Предел обнаружения магния — 10 мкг. Мешают ионы, образующие малорастворимые фосфаты; ионы NH4+, K+ и Na+ не мешают.
Выполнение реакции. К 1-2 каплям раствора, содержащего ионы магния, прибавляют 2-3 капли 2 М НС1, 1 каплю раствора Na2HPO4 и при перемешивании по каплям прибавляют 2 М NH4OH до появления запаха аммиака (рН ~9). Выпадает белый кристаллический осадок. Выпадение его можно ускорить трением стеклянной палочки о стенки пробирки. Из разбавленных растворов осадок выпадает медленно. В таких случаях рекомендуется выждать некоторое время.
2. Гидрофосфат натрия (микрокристаллоскопическая реакция). При медленной кристаллизации (разбавленный раствор соли магния) образуются кристаллы MgNH4PO4∙6H2O (рис. 2а), а при быстрой кристаллизации (более концентрированный раствор соли магния или раствор, содержащий большое количество ионов NH4+) образуются звездочки или древовидные образования (рис. 2б). Предел обнаружения магния – 0,6 мкг.
Рис. 2. Кристаллы
MgNH4PO4∙6H2O,
образующиеся при медленной (а)
и быстрой (б)
кристаллизации
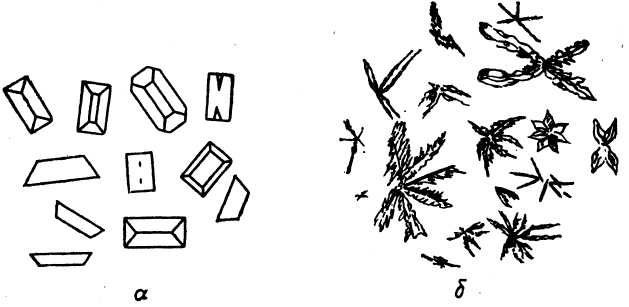
Выполнение реакции. На предметное стекло помещают каплю раствора, содержащего ионы магния, рядом помещают каплю раствора реагента (смесь Na2HPO4, NH4C1, NH3). Стеклянной палочкой соединяют капли и рассматривают под микроскопом образовавшиеся кристаллы (рис. 2).
3. Хинализарин (1,2,5,8-тетраоксиантрахинон) в щелочной среде с ионами магния образует осадок хинализарината магния синего цвета:

Предполагают, что хинализариновый лак, является адсорбционным соединением образующегося в щелочной среде гидроксида магния с реагентом. Предел обнаружения магния – 0,25 мкг. Реакция является избирательной: обнаружению не мешают ионы щелочноземельных металлов; в присутствии достаточно большого количества щелочи не мешают ионы Al3+. Ион аммония мешает обнаружению Mg2+, так как препятствует образованию гидроксида магния. Раствор реагента в щелочной среде окрашен в фиолетовый цвет, поэтому необходимо проведение контрольного опыта.
Выполнение реакции. Реакцию выполняют в 2 пробирках, одна из которых служит для сравнения цветов исходного и образующегося соединений. В каждую пробирку вносят по 10 капель 2 М раствора KOH и 2-3 капли раствора хинализарина, растворы перемешивают. Затем к содержимому одной из пробирок добавляют 2-3 капли соли магния. После перемешивания содержимое пробирки сравнивают с цветом раствора пробирки, служащей для сравнения. Раствор в пробирке, содержащий ионы магния, должен быть с осадком, окрашенным в синий цвет.
