
- •Клонування днк
- •Гель-електрофорез
- •Створення та скринінг геномних бібліотек
- •Полімеразна ланцюгова реакція
- •Секвенування днк
- •Біоінформатика
- •Експрессія рекомбінантних білків
- •Визначення стартових та кінцевих точок і рівня активності транскрипції
- •Аналіз експресії геному
- •Футпринтинг
- •Імунопреципітація хроматину
- •Рентгено-структурний аналіз
- •Дослідження структури макромолекул у розчині
- •Методи дослідження окремих макромолекул
- •Контрольні запитання
- •Рекомендована література
- •Предметний покажчик
Полімеразна ланцюгова реакція
Альтернативним і додатковим до клонування методом збільшення кількості бажаного фрагмента ДНК – ампліфікації – є полімеразна ланцюгова реакція (ПЛР або PCR – Polymerase Chain Reaction). Практично ПЛР – це реакція синтезу ДНК in vitro, яка повторюється багато разів: ланцюги, що синтезовані, стають матрицями для синтезу в наступному циклі реакції. Для здійснення ПЛР треба знати принаймні короткі послідовності ДНК на кінцях того фрагмента, що має бути ампліфікований.
Реакційна суміш містить слідову кількість вихідної ДНК, надлишкові кількості двох синтетичних праймерів до кінців фрагмента, нуклеозидтрифосфати чотирьох типів та ДНК-полімеразу Taq термофільної бактерії Thermus aquaticus. Використання саме полімерази Taq продиктовано тим, що вона не втрачає своєї активності при нагріванні до високих температур.
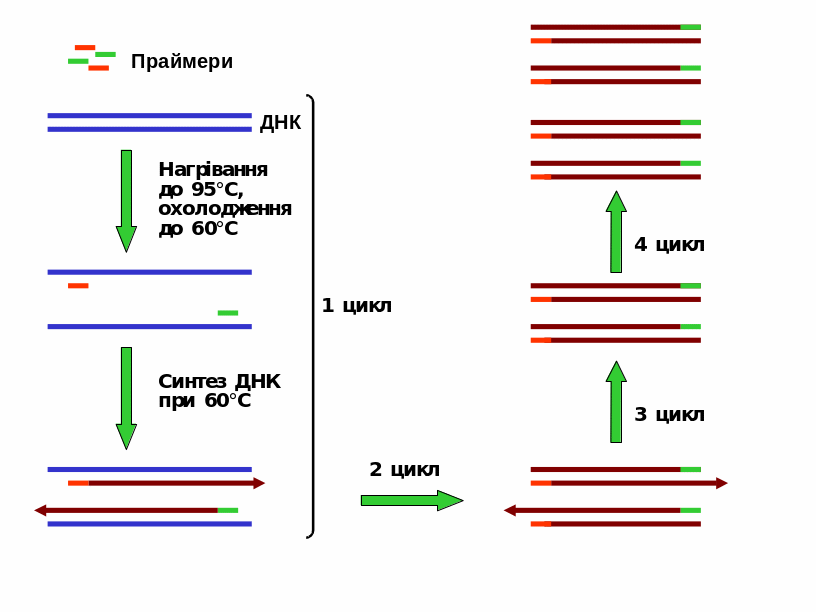 Рис.
11.7. Полімеразна
ланцюгова реакція. Деякі матриці,
довжина яких виходить за межі ділянки,
обмеженої двома праймерами, не показано
(число таких матриць після багатьох
циклів залишається дуже малим).
Рис.
11.7. Полімеразна
ланцюгова реакція. Деякі матриці,
довжина яких виходить за межі ділянки,
обмеженої двома праймерами, не показано
(число таких матриць після багатьох
циклів залишається дуже малим).
Усі наступні цикли ПЛР (реакція здійснюється у автоматичному режимі на приладі, що називається ампліфікатором) полягають, власне у нагріванні суміші до 95°С, яке змінюється охолодженням до 60°С. Після другого циклу будуть знов синтезовані дві такі самі молекули, як після першого, а також дві молекули, які показано на рис. 11.7. Після третього циклу – дві такі самі молекули, що й після другого, а також дві молекули, довжина яких чітко обмежена двома праймерами (рис. 11.7). Далі кількість таких коротких матриць буде зростати, і після 30-го циклу їх буде в мільйон разів більше, ніж вихідних довгих матриць.
Метод ПЛР має надзвичайно широке застосування. Він використовується кожного разу, коли є необхідність детектувати та дослідити невелику кількість ДНК, у тому числі – у складі неочищеного біологічного матеріалу. ПЛР застосовують також у комбінації з клонуванням: ампліфікований ДНК-продукт можна клонувати і використати, наприклад, для експресії білка (див. нижче); ампліфікація за допомогою ПЛР стає в нагоді для збільшення невеликої кількості клонованої ДНК.
ПЛР застосовують також для ампліфікації мРНК у вигляді її кДНК-копій – після синтезу кДНК на мРНК за допомогою зворотної транскриптази: варіант ПЛР, що позначається як RT-PCR (Reverse Transcriptase Polymerase Chain Reaction). Абревіатура RT-PCR використовується також у іншому значенні – Real Time Polymerase Chain Reaction (інше позначення: QRT-PCR – Quantitative Real Time Polymerase Chain Reaction): процедура, в якій ампліфікація ДНК супроводжується визначенням її кількості після кожного раунду за допомогою флуоресцентних барвників.
