
- •П оликристаллические материалы на основе алмаза киев наукова думка 1989 г оглавление
- •Предисловие
- •Глава I написана а. А. Шульженко и в. А. Шишкиным, глава II — в. А. Шишкиным и а. А. Бочечкой, в написании глав III— V принимали участие все авторы. Список условных обозначений
- •Глава I получение и свойства поликристаллических материалов на основе алмаза
- •Материалы, синтезированные из неалмазного углерода
- •Материалы, спеченные из микропорошков алмаза
- •Многослойные поликристаллические материалы
- •Материалы на металлической или металлокерамической связках
- •Структура поликристаллических материалов
- •Глава II аппараты высокого давления для получения поликристаллических материалов
- •Типы аппаратов
- •Эксплуатация аппаратов
- •Глава III свойства алмазных порошков для получения поликристаллических материалов на основе алмаза
- •Прочность порошков синтетического алмаза при сжатии
- •Прочность порошков синтетического алмаза при сжатии
- •Зависимость свойств алмазных порошков от содержания включений
- •Изменение состава алмазных порошков при нагреве и взаимодействии с газами
- •Изменение физико-механических свойств алмазных порошков при нагреве под давлением
- •Глава IV твердофазное спекание алмазных порошков при высоких давлениях
- •Холодное уплотнение порошков алмаза
- •Уплотнение порошков алмаза при термобарическом воздействии
- •Формирование структуры поликристаллов при спекании порошков
- •Зависимость свойств спеченных поликристаллов от состава поверхности алмазных порошков
- •Элемент или функциональная группа
- •Взаимодействие сжатого алмазного порошка с газами
- •Глава V жидкофазное спекание алмазных порошков при высоких давлениях
- •Взаимодействие алмаза с переходными металлами
- •Механизм пропитки алмазных порошков
- •Кинетика пропитки алмазных порошков жидкими металлами и сплавами металл — углерод
- •Пропитка алмазных порошков кобальтом из твердосплавной подложки
- •Спекание поликристаллов на основе алмаза методом пропитки алмазных порошков
- •Список литературы
Взаимодействие сжатого алмазного порошка с газами
В порах алмазного брикета, сформировавшегося после нагружения АВД, находится воздух. Из газов атмосферы наибольшую активность по отношению к алмазу проявляет кислород. К тому же, как уже отмечалось, на поверхности алмазных частиц находится слой хемо-сорбированного кислорода. Как показали многочисленные исследования взаимодействия кислорода с монокристаллами алмаза и алмазными порошками при атмосферном давлении (см. гл. III), окисление алмазов в зависимости от размеров зерна, состояния поверхности, наличия включений и примесей начинается при 876— 1073 К и ведет к ухудшению физико-механических характеристик алмазных порошков, материалов и инструментов на их основе. В ряде работ [200, 245] высказано предположение о том, что при взаимодействии кислорода или диоксида углерода в закрытом объеме с алмазными зернами происходит графитизация алмаза путем реакции с газовой фазой. Термодинамический расчет констант равновесия реакций в системе углерод — кислород подтвердил возможность такого процесса, так как указанные константы для алмаза в рассмотренном диапазоне температур больше таковых для графита.
Как было показано в параграфе 2 настоящей главы, в начальный период (7 с) спекания алмазного порошка при среднем давлении 8,0 ГПа в реакционной зоне давление газов в порах при 2300 К не превышает 13,0 МПа. В этом случае частицы алмаза находятся в сложном напряженном состоянии. Распределение напряжения по объему соприкасающихся частиц зависит от их формы, физико-механических свойств и взаимного расположения, величины площадки контакта, передаваемого усилия сжатия.
На наш взгляд, в реальной картине распределения напряжения в части объема алмазной частицы, прилегающей к ее внеконтактной поверхности, можно выделить два крайних случая: напряжение в поверхностном слое равно давлению газов в порах: напряжение в поверхностном слое, по крайней мере в плоскости, перпендикулярной поверхности частицы, превышает давление газов в порах.
В первом случае, по существу, реализуются описанные выше условия графитизации алмаза в закрытом объеме путем взаимодействия с газовой фазой. Во втором случае высокое напряжение в поверхностном слое частицы свидетельствует об уменьшении объема приповерхностной области вследствие действия высокого давления в твердой фазе. Такое уменьшение объема приводит к изменению свободной энергии системы.
Таблица 19. Термодинамические свойства исследуемых веществ

O2 СОГ
Температура, К
ST, Дж/(КХ Хмоль)
H0(T)- Н° (298,15), кДж/моль
ST, Дж/(КХ Хмоль)
H0(T)- H0(298,15), кДж/моль

298,15 |
205,0 |
0 |
197,548 |
0 |
500 |
220,6 |
6,085 |
212,725 |
5,917 |
1000 |
243,471 |
22,706 |
234,429 |
21,687 |
1500 |
257,966 |
33,61 |
248,315 |
38,845 |
2000 |
268,655 |
59,202 |
258,601 |
56,736 |
2500 |
277,210 |
78,283 |
266,756 |
75,014 |
3000 |
284,403 |
98,117 |
273,506 |
93,528 |
Примечание:
![]() Н°
(298,15)
= 0; —110,530; —393,510; 0; 1,85±0,1б кДж/моль
Н°
(298,15)
= 0; —110,530; —393,510; 0; 1,85±0,1б кДж/моль
Поэтому
ответить на вопрос о возможности
протекания граффитизации алмазных
частиц через газовую фазу в этом случае
можно при помощи термодинамического
расчета констант равновесия
гетерогенных реакций газов с твердой
фазой, учитывая для такой системы
влияние уменьшения объема твердой
фазы на свободную энергию Гиббса. Если
в системе происходит гетерогенная
реакция типа
![]() ,
то изменение свободной энергии системы
определяется уравнением [65]
,
то изменение свободной энергии системы
определяется уравнением [65]
![]() ,
(IV.17)
,
(IV.17)
где рв и рБ — парциальные давления участвующих в реакции газов; пъ п2, п3 — стехиометрические коэффи-циенты.
При этом парциальное давление (или концентрация) твердой фазы не входит в правую часть уравнения (IV. 17). При равновесии в системе ( G = 0)
![]() (IV.18)
(IV.18)
В случае, когда рБ == рв = 1 атм. (т. е. когда давление исходного газа и давление образованного в результате реакции газа равно атмосферному),
G = — RTlnKp; lnKp = -( G/(RT). (IV. 19)
СО2г |
Сгр |
Сал |
|||
SТ, Дж/(КХ Хмоль) |
Н0(Т)-Н° (298,15), кДж/моль |
ST, Дж/(КХ Хмоль |
H0(T) –H0 (298,15), кДж/моль |
sr. Дж/(КХ Хмоль) |
H0(Г)- H° (298,15), кДж/моль |
213,674 |
0 |
5,740 |
0 |
2,362 |
0 |
234,785 |
8,308 |
11,793 |
2,417 |
7,434 |
2,042 |
269,187 |
33,404 |
24,451 |
11,744 |
19,886 |
11,275 |
292,095 |
61,720 |
33,799 |
23,317 |
29,506 |
23,180 |
309,193 |
91,460 |
40,892 |
35,653 |
36,697 |
35,677 |
322,789 |
121,935 |
46,514 |
48,255 |
42,323 |
48,285 |
334,062 |
152,855 |
51,337 |
61,500 |
47,237 |
62,037 |
Последнее уравнение обычно используют для определения констант скорости реакций, вычисляя значение G по данным о термодинамических величинах, которые приводятся в справочной литературе, и исходя из соотношения
G = H — T S, (IV.20)
дпя О2; СОГ; СО2г, Сгр; Сал соответственно.
где Н и S — изменение энтальпии и энтропии системы в результате реакции.
Значения энтальпии и энтропии, участвующих в реакции веществ в стандартных состояниях при атмосферном давлении, приводятся в справочной литературе [182]. Энтальпия вещества при Т определяется выражением
Н(Т) = Н0(То) + Н0(Т) — Н0(Т0), (IV.21)
где То — температура стандартного состояния;
fH°(То) —энтальпия образования вещества в стандартном состоянии; Н° (Т) — Н° (То) — изменение энтальпии при нагреве вещества от То до Т.
Эта величина, как известно [65], вычисляется следую щим образом:
H°
(Т)
—
Н°
(То)
=
![]() Ср
(Т) dT. (IY.22)
Ср
(Т) dT. (IY.22)
Энтропия вещества ST при температуре Т имеет вид
![]() (IV.23)
(IV.23)
где
![]() —
энтропия
в стандартном состоянии.
—
энтропия
в стандартном состоянии.
В системе углерод — кислород с участием твердой фазы могут протекать реакции
Сал
+ О2![]() СО2; (IV.24)
СО2; (IV.24)
Cгр+O2 СО2; (IV.25)
2Сал+О2 2СО ; (IV.26)
2Сгр+О2 2СО ; (IV.27)
Сал+СО2 2СО; (IV 28)
СГР + СО2 2СО. (IV .29)
Для участвующих в этих реакциях веществ (кроме алмаза) в [182] приводятся значения Н°(Т)— H° (0). Поскольку за стандартное состояние в настоящей работе принимается р = 1 атм., То = 298,15 К (25 °С), то значения Н° (Т) — Н° (298,15) вычислялись по формуле H0 (Т) — H0 (298,15) = [H0 (Т) — H0 (0)] —
— [H0 (298,15) —H0 (0)]. (IV.30)
Для алмаза приводятся значения S298.15, H° (298,15) и выражения для теплоемкости
Сp = — 1,892 + 43,045 • 10-3 • Т — 2,592 • 105 . T-2 —
— 22,752 . 10-6 • Г2 + 3,987 . 10-9 . Т3.
Поэтому
значения H0 (Т) — Н° (298,15) и ST для алмаза
вычислялись по формулам (IV.22) и (IV.23).
Значения
![]() (298,15),
H0 (T) —H0 (298,15), ST, взятые из [182] и вычисленные
по формулам (IV.22), (IV.23), (IV.30) для веществ,
участвующих в указанных выше реакциях,
приведены в табл. 19.
(298,15),
H0 (T) —H0 (298,15), ST, взятые из [182] и вычисленные
по формулам (IV.22), (IV.23), (IV.30) для веществ,
участвующих в указанных выше реакциях,
приведены в табл. 19.
Изменение свободной энергии Гиббса, вызванное уменьшением объема твердой фазы из-за действия высокого давления, учтем следующим образом. Как известно [65],
(dG/dp)T=V. (IV.31)
Отсюда изменение свободной энергии вещества при увеличении давления от р0 до p запишем в виде
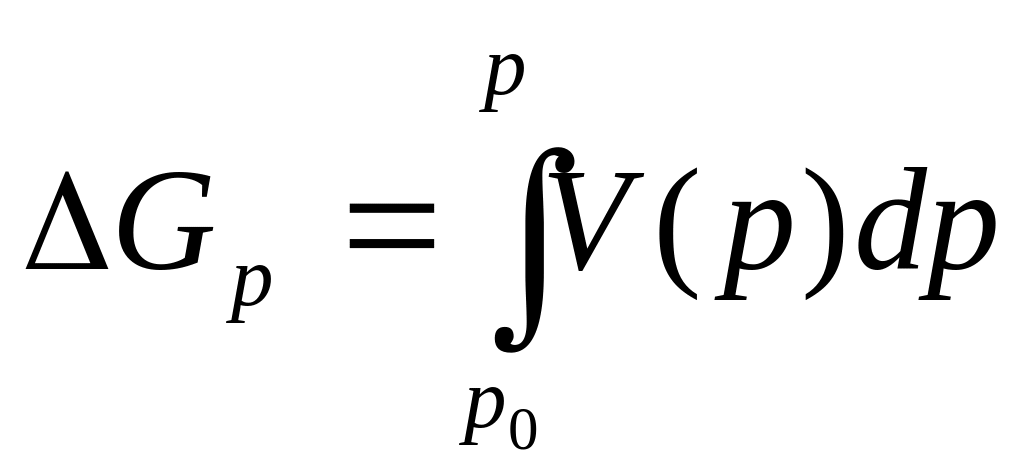 (IV.32)
(IV.32)
Зависимость молярного объема твердого тела от давления можно представить следующим образом:
V (р) = V0- V=V0- V0 (p – p0), (IV.33) где V0 — молярный объем при давлении р0 и температуре Т.
В свою очередь,
V0
=
![]() [l
+ 3
'(T-T0)]. (IV.34)
[l
+ 3
'(T-T0)]. (IV.34)
Подставляя выражение для V (р) из (IV.34) и (IV.33) в (IV.32), получаем
![]() .
.
(IV.35)
Значения GP, вычисленные по формуле (IV.35) для алмаза и графита при давлении р = 8,0 ГПа и различных температурах, представлены в табл. 20. Для расчета из [6] брались следующие значения входящих в формулу (IV.35) величин: А == 12 • 10-3 кг, =3,515 X
X 103 кг/м3, ' = 3,7 . 10-6 К-1 , = 2,3 • 10-12 Па-1 для алмаза; = 2,267 . 103 кг/м3, = 20 .10-6 К-1, = 25,5 • 10-12 Па-1 для графита.
Таким образом, процедура вычисления константы реакции при температуре Т и давлении р в твердой фазе
Таблица 20. Изменение свободной энергии графита и алмаза при сжатии до 8,0 ГПа
T, K |
|
кДж/моль |
Т, К |
, |
к Д ж/моль |
||
Графит |
|
Алмаз
|
Графит |
|
Алмаз |
||
298,15 500 1000 1500 |
42,338 42,859 44,147 45,394 |
27,316 27,353 27,519 27,686 |
2000 2500 3000 |
46,725 48,013 49,136 |
27,769 28,060 28,184 |
||
сводится
к следующему. По данным табл. 19 вычисляется
изменение энтальпии и энтропии системы
в результате реакции при атмосферном
давлении. Затем по формуле (IV. 20)
вычисляется изменение свободной энергии
Гиббса. К этому изменению прибавляется
изменение
![]() (табл. 20 или формула (IV.35)), вызванное
повышением давления в твердой фазе.
Если вещество под давле- нием — исходный
продукт, то значение
GP
прибавляется со знаком минус, если
вещество под давлением — продукт
реакции, то
GP
прибавляется со знаком плюс. Найденное
таким образом значение
подставляется в формулу (IV. 19), по которой
вычисляется значение константы
равновесия реакции.
(табл. 20 или формула (IV.35)), вызванное
повышением давления в твердой фазе.
Если вещество под давле- нием — исходный
продукт, то значение
GP
прибавляется со знаком минус, если
вещество под давлением — продукт
реакции, то
GP
прибавляется со знаком плюс. Найденное
таким образом значение
подставляется в формулу (IV. 19), по которой
вычисляется значение константы
равновесия реакции.
Как указывается в [65], при постоянной температуре величина константы равновесия не зависит от давления участвующих в реакции газов в пределах давлений, в которых реагирующие газы подчиняются уравнению Менделеева — Клапейрона. Как уже отмечалось выше, в нашем случае объем поры за 7 с спекания порошка уменьшается не более чем в 17 раз. Поскольку при нормальных условиях плотность воздуха составляет 1,25 кг/м3, то после такого уменьшения объема она составит 21,25 кг/м3, что в 16 раз меньше критической [62]. Это означает, что газы, захлопнутые в порах, подчиняются уравнению состояния идеального газа — уравнению Менделеева — Клапейрона и увеличение давления в газах, вызванное уплотнением алмазного порошка при таком спекании, не вызовет изменения константы скорости реакции, вычисленной в предположении, что парциальные давления участвующих в реакции газов равны атмосферному.
Ю р,ГПа
1500 2000 2500 Т,К
Б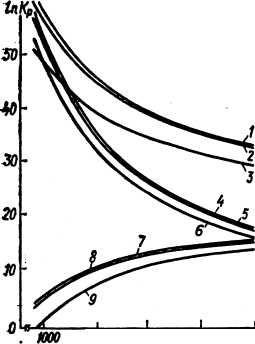 ыл
выполнен расчет констант равновесия
реакций (IV.24) — (IV.29) в зависимости
от температуры для
ыл
выполнен расчет констант равновесия
реакций (IV.24) — (IV.29) в зависимости
от температуры для
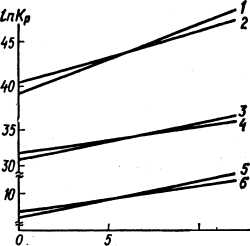
Рис. 45. Температурная зависимость констант равновесия реакций {IV.24) (5), (IV.25) (4, 61 (IV.26) (2), (IV.27) (1, 3), (IV.28) (8)t (IV.29) {7,9) в системе С—О2 при атмосферном давлении (3, 6, 9) и давлении 8,0 ГПа в твердой фазе (1, 2, 4, 5, 7, 8)
Рис. 46. Зависимость при 1500 К от давления в твердой фазе констант равновесия реакций:
7 — (IV.27); 2 — (IV.26); 3 — (IV.25); 4 — (IV.24); 5 — (IV.29); 6 — (IV.28)
случая,
когда алмаз и графит сжаты до давления
3,0 ГПа, а также изучена зависимость
констант равновесия реакций от
давления при 1500 К 121]. Результаты
представлены на рис. 45 и рис. 46. На рис.
45 показаны также значения констант
равновесия реакций с графитом, который
не испытывает действия высокого
давления. С ростом давления увеличиваются
константы равновесия реакций газовой
фазы как с алмазом, так и с графитом, но
так как графит имеет больший мольный
объем, чем алмаз, то рост Kр в случае
графита опережает рост Кр в случае
алмаза и примерно при р > 6 ГПа линии
констант равновесия реакций с
графитом лежит выше линий констант
равновесия реакций с алмазом (при этом
значения температуры и давления
соответствуют области стабильности
алмаза). Но если в АВД сжат алмазный
порошок, то давление газов в порах
незначительное, а графит может выделяться
только на свободных поверхностях
алмазных зерен. И до тех пор, пока будет
сохранять достаточную жесткость
алмазный каркас, графит, возникший в
порах, не будет сжат до высоких давлений.
А в таком случае, как видно из рис. 45,
линии констант равновесия реакций с
графитом лежат значительно ниже линий
констант равновесия реакций с алмазом.
Это ведет к тому, что графитизация
сжатого в АВД алмазного порошка
может происходить путем реакций с
газами, находящимися в порах алмазного
брикета. Рассмотрим подробнее возможный
механизм такой графитизации. Представим
себе закрытую пору, в которой наряду с
азотом, углекислым газом находится
кислород. Алмазный порошок сжат
таким образом, что часть зерна,
контактирующая с газом, находится
в области термодинамической
стабильности алмаза (допустим при
температуре большей 900 К). Согласно
рис. 45, наиболее вероятной реакцией
алмаза с кислородом будет реакция
(IV.26). Через определенное время парциальное
давление угарного газа СО достигнет
такой величины, что в системе в обратном
направлении пойдет реакция (IV.29) 2СО
![]() СО2 + Сгр. При этом из-за очень большой
разницы между константами равновесия
реакций (IV.26) и (IV.29) реакция (IV.29) идет в
обратном направлении, в то время как
реакция (IV.26) продолжает идти в прямом,
так как равновесное давление СО для
реакции {IV.26) не достигается. Так будет
продолжаться до тех пор, пока в поре
будет находиться непрореагировавший
кислород. После этого, по-видимому,
графитизация будет осуществляться
путем прохождения реакций Сал + + СО2
2СО; 2СО
СО2 + Сгр, поскольку из-за разности
констант равновесия реакций с алмазом
и графитом в системе устанавливается
такое парциальное давление СО,
которое обусловливает протекание
реакции (IV.28) в прямом, а реакции (IV.29) —
в обратном направлениях. Предложенный
механизм протекания реакций
представляется наиболее вероятным.
Однако, возможно, особенно при
температурах меньше 900 К, сначала
идет образование СО2, затем его окисление
до СО и далее реакция (IV.29) в обратном
направлении. Возможны и другие механизмы.
Для выяснения деталей протекания
реакций алмаза с газами необходимы
дальнейшие исследования.
Термодинамические расчеты устанавливают
только возможность графитизации алмаза
та- ким путем. Итак, даже в том случае,
когда из-за действия высокого давления
часть объема сжатой алмазной частицы,
которая прилегает к внеконтактной
поверхности, находится в области
термодинамической стабильности
алмаза, из-за взаимодействия с газовой
средой, находящейся в порах, возможна
ее графитизация.
СО2 + Сгр. При этом из-за очень большой
разницы между константами равновесия
реакций (IV.26) и (IV.29) реакция (IV.29) идет в
обратном направлении, в то время как
реакция (IV.26) продолжает идти в прямом,
так как равновесное давление СО для
реакции {IV.26) не достигается. Так будет
продолжаться до тех пор, пока в поре
будет находиться непрореагировавший
кислород. После этого, по-видимому,
графитизация будет осуществляться
путем прохождения реакций Сал + + СО2
2СО; 2СО
СО2 + Сгр, поскольку из-за разности
констант равновесия реакций с алмазом
и графитом в системе устанавливается
такое парциальное давление СО,
которое обусловливает протекание
реакции (IV.28) в прямом, а реакции (IV.29) —
в обратном направлениях. Предложенный
механизм протекания реакций
представляется наиболее вероятным.
Однако, возможно, особенно при
температурах меньше 900 К, сначала
идет образование СО2, затем его окисление
до СО и далее реакция (IV.29) в обратном
направлении. Возможны и другие механизмы.
Для выяснения деталей протекания
реакций алмаза с газами необходимы
дальнейшие исследования.
Термодинамические расчеты устанавливают
только возможность графитизации алмаза
та- ким путем. Итак, даже в том случае,
когда из-за действия высокого давления
часть объема сжатой алмазной частицы,
которая прилегает к внеконтактной
поверхности, находится в области
термодинамической стабильности
алмаза, из-за взаимодействия с газовой
средой, находящейся в порах, возможна
ее графитизация.
Следует заметить, что, поскольку часть объема алмазной частицы находится в области термодинамической стабильности графита, графитизация возможна и без участия газовой фазы путем прямой перестройки решетки алмаза в решетку графита. Однако, поскольку энергия активации процесса окисления меньше энергии активации процесса графитизации без участия газовой фазы, несомненно, что взаимодействие с кислородом ускоряет этот процесс. К тому же такая графитизация может начаться при более низких температурах.
Графитизация алмазных зерен при спекании алмазных порошков ведет к резкому уменьшению электрического сопротивления спеченной алмазной керамики и ухудшению ее физико-механических свойств. Графит, который выделяется в порах алмазного поликристалла, имеет ниэкую теплопроводность, и поэтому спеченные поликристаллические образцы имеют теплопроводность порядка 100—130 Вт/(м • К) [106], что намного ниже теплопроводности монокристаллов алмаза [6]. Повышения теплопроводности поликристалла можно добиться, если увеличить величину перешейков между зернами алмаза. Этого можно было бы достичь, если бы удалось увеличить длительность спекания при температурах выше 1870 К, когда пластическое течение алмаза проявляется при сравнительно невысоких напряжениях (порядка 1 ГПа) [222]. Но при таких температурах процессы роста перешейков и графитизации являются конкурирующими, поэтому осуществление сравнительно длительного спекания алмазного порошка без уменьшения интенсивности графитизации невозможно.
Из-за ограниченности времени спекания и интенсивной графитизации зерна образованного поликристалла слабо связаны между собой. Поэтому поликристаллы, спеченные из алмазного порошка без применения добавок, активирующих спекание, имеют низкую твердость и прочность, низкое электросопротивление.
Как показано выше, ухудшение прочности зерен алмаза, травление их поверхности и интенсивная графити-зация в условиях высоких давлений и температур вызваны прежде всего взаимодействием сжатого алмазного порошка с газами, находящимися в порах и адсорбированными поверхностью алмазных зерен, и в первую очередь с кислородом. Поэтому защита алмазного порошка от взаимодействия с кислородом при спекании позволит улучшить структуру и физико-механические свойства алмазного поликристалла.

Рис. 47. Структура поликристалла алмаза, спеченного из порошка ACT (100/80) за 10 (а) и 60 (б) с (х 100)
В патенте ФРГ [140] описывается способ спекания алмазных поликристаллов, по которому алмазный поро-иок окружается дисками из циркония. По-видимому, цирконий в условиях спекания связывает кислород, что дает возможность осуществить такую защиту.
На рис. 47 показана структура поликристаллов, спеченных из алмазного порошка зернистостью 100/80 при одних и тех же давлении и температуре. Применение мер защиты от взаимодействия с кислородом дало возможность увеличить время спекания в шесть раз. При этом электрическое сопротивление образца, замеренное между торцами, составляло 109 Ом, а теплопроводность 443 Вт/(м • К), в то время как сопротивление контрольного образца, имеющего такие же геометрические размеры, составляло 104 Ом, а теплопроводность 262 Вт/(м • К). Как видно, применением указанных мер удалось резко уменьшить интенсивность графитизации (о чем красноречиво свидетельствует разница в сопротивлении образцов) и получить поликристаллы с плотно связанными алмазными зернами, имеющими высокие теплопроводность и электрическое сопротивление.
