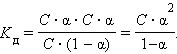3. Криоскопическая и эбулиоскопическая константы
Коэффициенты пропорциональности К и Е в приведённых выше уравнениях — соответственно криоскопическая и эбулиоскопическая постоянные растворителя, имеющие физический смысл понижения температуры кристаллизации и повышения температуры кипения раствора с концентрацией 1 моль/кг. Для воды они равны 1.86 и 0.52 K·моль−1·кг соответственно. Поскольку одномоляльный раствор не является бесконечно разбавленным, второй закон Рауля для него в общем случае не выполняется
эбуллиоскопическая и криоскопическая константы (зависят от природы растворителя, независят от природы вещества и концентрации).
В настоящее время коллигативные свойства используются главным o6pазом для определениямолекулярных масс неизвестных веществ. … Законы Рауля можно использовать дляопределения молекулярных масс (Мр-го) растворенных веществ: ΔtК = tК р-ра = tК р-ля = Е ∙ См;
ΔtЗ = tК р-ра = tЗ р-ля = Е ∙ См. значения молекулярных масс полимеров устанавливают с помощью методов, основанных на коллигативных свойствах разбавленных растворов, по числу двойных связей или функциональных, а также по таким свойствам их растворов, как вязкость, светорассеяние.
"20% раствор" означает, что в 100 г раствора содержится 20 г глицерина и соответственно 0 г (или 0.08 кг) воды. n(глицерина) = m(глицерина) / М(глицерина) = 20 / 92 = 0.217 моль b(х) = n(глицерина) / m(H2O) = 0,217 / 0.08 = 2,713 моль/кг По закону Рауля ΔТ = K * Cm = 1.86 * 2,713 = 5,04 Ткрист(раствора) = Ткрист(растворителя) - ΔТ = 0 – 5,04 = -0,504оС
4. Ионообменная адсорбция представляет собой процесс обмена ионов между раствором и твердой фазой - адсорбентом. Вещества, способные к ионному обмену, получили название ионитов. В зависимости от того какой вид ионов участвует в обмене, иониты делят на катиониты и аниониты. Широкое применение ионообменная адсорбция получила с развитием синтетических ионитов на основе органических смол, сульфоуглей, ионцеллюлоз.
Ионообменные смолы — синтетические органические иониты — высокомолекулярные синтетические соединения с трехмерной гелевой и макропористой структурой, которые содержат функциональные группы кислотной или основной природы, способные к реакциям ионного обмена. Свойства
Ионообменные смолы представляют собой твёрдые полимеры, нерастворимые, ограниченно набухающие в растворах электролитов и органических растворителях. Они способны к ионному обмену в водных и водноорганических растворах.
По структуре матрицы ионообменные смолы делятся на:
гелевые — микропоры имеют молекулярные размеры. Они представляют собой гомогенные поперечносвязанные полимеры. Фиксированные ионы равномерно распределены по всему объему полимера. Гелевые ионообменные смолы обладают высокой обменной емкостью, однако характеризуются невысокой скоростью обмена
макропористые — размеры пор смолы имеют размеры в десятки нанометров. Имеют фиксированную систему пор и каналов, определяемую условиями синтеза. Обменная ёмкость таких смол меньше, чем гелевых при высокой скорости обмена
Ионообменные смолы в основном применяются:
для умягчения и обессоливания воды в теплоэнергетике и других отраслях;
для разделения и выделения цветных и редких металлов в гидрометаллургии;
при очистке возвратных и сточных вод;
для регенерации отходов гальванотехники и металлообработки;
для разделения и очистки различных веществ в химической промышленности;
в качестве катализатора для органического синтеза.
Ионообменные смолы используются в котельных, теплоэлектростанциях, атомных станциях, пищевой промышленности (при производстве сахара, алкогольных, слабоалкогольных и других напитков, пива, бутилированной воды), фармацевтической промышленности и других отраслях.
Разделение смеси веществ в жидкостно-жидкостной хроматографии основываются на различии коэффициентов распределения вещества между несмешивающимися растворителями. Коэффициент распределения вещества равен:
Кп/н = сп / сн
Где сп и сн – концентрация вещества в подвижной и неподвижной фазах.
Ионы хлора связываются с положительно заряженными функциональными группами анионообменника и вытесняют карбоксильные группы белков. При низких концентрациях соли элюируются белки, слабо связанные с анионообменником. Постепенное увеличение концентрации соли или изменение рН, что меняет заряд белковой молекулы, приводит к выделению белковых фракций, в одной из которых находится искомый белок.
5. Частицы в коллоидных системах, так же как молекулы в истинных растворах, находятся в непрерывном хаотическом движении. Для коллоидных частиц это движение получило название броуновское движение. Коллоидные частицы перемещаются под воздействием ударов, наносимых им молекулами среды, находящимися в тепловом движении. Броуновское движение не зависит от природы дисперсной фазы, а зависит только от размеров частиц. Чем меньше размер частиц, тем больше интенсивность...
Седимента́ция (осаждение) — оседание частиц дисперсной фазы в жидкости или газе под действием гравитационного поля или центробежных сил. Фактором, противодействующим седиментации, является диффузия, стремящаяся выравнять концентрации по всему объему. Действие гравитационных сил оказывается преобладающим лишь для более крупных частиц. Для мелких частиц скорость диффузии достаточна, чтобы предотвратить их оседание. Совокупное действие седиментации и диффузии приводит к установлению с течением времени седиментационного равновесия, характеризующегося постепенным уменьшением концентрации от нижних к верхним слоям раствора. Скорость седиментации зависит от массы, размера, формы и плотности вещества частицы, вязкости и плотности среды, а также от ускорения силы тяжести и действующих на частиц центробежных сил.
Билет 16(8)
1. Диффу́зия — процесс взаимного проникновения молекул одного вещества между молекулами другого, приводящий к самопроизвольному выравниванию их концентраций по всему занимаемому объёму[1]. В некоторых ситуациях одно из веществ уже имеет выравненную концентрацию и говорят о диффузии одного вещества в другом. При этом перенос вещества происходит из области с высокой концентрацией в область с низкой концентрацией (против градиента концентрации).
Примером диффузии может служить перемешивание газов (например, распространение запахов) или жидкостей (если в воду капнуть чернил, то жидкость через некоторое время станет равномерно окрашенной). Другой пример связан с твёрдым телом: атомы соприкасающихся металлов перемешиваются на границе соприкосновения. Важную роль диффузия частиц играет в физике плазмы.
Обычно под диффузией понимают процессы, сопровождающиеся переносом материи, однако иногда диффузионными называют также другие процессы переноса: теплопроводность, вязкое трение и т. п.
Скорость протекания диффузии зависит от многих факторов. Так, в случае металлического стержня тепловая диффузия проходит очень быстро. Если же стержень изготовлен из синтетического материала, тепловая диффузия протекает медленно. Диффузия молекул в общем случае протекает ещё медленнее. Например, если кусочексахара опустить на дно стакана с водой и воду не перемешивать, то пройдёт несколько недель, прежде чем раствор станет однородным. Ещё медленнее происходит диффузия одного твёрдого вещества в другое. Например, если медь покрыть золотом, то будет происходить диффузия золота в медь, но при нормальных условиях (комнатная температура и атмосферное давление) золотосодержащий слой достигнет толщины в несколько микронов только через несколько тысяч лет.
2.1 Слабые электролиты — химические соединения, молекулы которых даже в сильно разбавленных растворах незначительно диссоциированны на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. К слабым электролитам относится большинство органических кислот и многие органические основания в водных и неводных растворах.
2.2 Важнейшей характеристикой слабого электролита служит константа диссоциации.
|
|
|
Если выразить равновесные концентрации через концентрацию слабого электролита C и его степень диссоциации α, то получим
|
|
|
Это соотношение называют законом разбавления Оствальда. Для очень слабых электролитов при α << 1 это уравнение упрощается:
|
|
|
Тогда
|
|
2.3Добвление в раствора одноименного иона согласно принципу ле-шателье уменьшает степень диссоциации.А разбавление раствора увелечивает степень диссоциации.
4.1 Диспе́рсная систе́ма — это система, образованная из двух или более фаз (тел), которые совершенно или практически не смешиваются и не реагируют друг с другом химически. Первое из веществ (дисперсная фаза) мелко распределено во втором (дисперсионная среда). Если фаз несколько, их можно отделить друг от друга физическим способом (центрифугировать, сепарировать и т. д.).
Обычно дисперсные системы — это коллоидные растворы, золи. К дисперсным системам относят также случай твёрдой дисперсной среды, в которой находится дисперсная фаза.
По размеру частиц дисперсной фазы различают грубодисперсные системы (взвеси) с размером частиц более 500 нм и тонкодисперсные (коллоидные растворы или коллоиды) с размерами частиц от 1 до 500 нм.
Дисперсные системы классифицируют также по степени взаимодействия между дисперсионной средой и дисперсной фазой. Если такое взаимодействие выражено очень слабо, систему называют лиофобной (в случае воды - гидрофобной). Примером гидрофобной системы может служить «баритовая каша» - осадок сульфата бария, получаемый смешиванием растворов, содержащих катион бария и сульфат-анион. Если же дисперсная фаза и дисперсионная среда «тяготеют» друг к другу (например, образуют водородные связи), образуется лиофилъная (гидрофильная) дисперсионная система. Такие системы образуются самопроизвольно и очень устойчивы. К ним относятся растворы высокомолекулярных соединений, например белков. Многие глобулярные белки диспергированы в водных растворах до отдельных молекул, но, поскольку их размеры составляют десятки нанометров, раствор нельзя считать истинным - это дисперсная система.
4.2Коллоидные системы— дисперсные системы, промежуточные между истинными растворами и грубодисперсными системами — взвесями. Или это система, в которой дискретные частицы, капли или пузырьки дисперсной фазы, имеющие размер хотя бы в одном из измерений от 1 до 1000 нм, распределены в другой фазе, обычно непрерывной, отличающейся от первой по составу или агрегатному состоянию и именуемой дисперсионной средой.
Размеры коллоидных частиц варьируются в пределах от 0.001 до 0.1 мкм. В свободнодисперсных коллоидных системах (дымы, золи) частицы не выпадают в осадок
5. Коагуляция - это слипание частиц коллоидной системы при их столкновениях в процессе теплового движения, перемешивания или направленного перемещения во внешнем силовом поле. В результате коагуляции образуются агрегаты - более крупные (вторичные) частицы, состоящие из скопления мелких (первичных).
Причины коагуляции многообразны. Едва ли существует какое либо внешнее воздействие, которое при достаточной интенсивности не вызывало бы коагуляцию.