
- •Лекция 2 Горение топлива
- •2. Процессы воспламенения и горения топлива
- •2.1 Сущность горения
- •2.2 Воспламенение
- •2.3 Виды горения и механизм распространения пламени.
- •2.4 Теплота сгорания топлива.
- •2.5. Энтальпия топлива и продуктов сгорания.
- •2.6 Преобразование тепловой энергии продуктов сгорания в механическую работу.
- •Температура продуктов сгорания
- •Молекулярный вес продуктов сгорания и их состав
- •Теплоемкость продуктов сгорания и показатель адиабаты
- •Скорость и полнота сгорания топлива
- •Требования к топливу как к рабочему телу системы подачи
2.4 Теплота сгорания топлива.
Высшая и низшая теплотворность
Теплотой сгорания (теплотворностью) называется количество тепла, выделяемое при полном сгорании 1 кг топлива и охлаждении продуктов сгорания до исходной температуры (обычно 20°С). Ее определяют опытным путем, сжигая в калориметре в среде сжатого кислорода навеску топлива. Выделенную теплоту рассчитывают по нагреву воды в калориметрическом сосуде. При данном способе определения теплотворной способности топлива учитывается теплота конденсации паров воды и такая теплотворная способность называется высшей. При работе реальных двигателей пары воды вместе с другими продуктами сгорания выбрасываются в атмосферу в газообразном состоянии и если и конденсируются, то уже вне двигателя, естественно не совершая при этом никакой работы. Поэтому для характеристики топлива применяют низшую теплоту сгорания, которая меньше высшей на теплоту конденсации паров воды.
Выделение теплоты при горении в первую очередь связано с перестройкой химических связей между химическими элементами исходных и конечных продуктов реакции. Процесс перестройки заключается в первоначальном разрушении относительно слабых химических связей в молекулах горючего и окислителя и последующим образованием молекул окислов, являющихся более устойчивыми веществами и обладающих значительно более прочными связями. Разрушение химических связей является энергозатратным процессом и связан с поглощением тепла. В тоже время образование химических связей сопровождается выделением тепловой энергии.
Каждая химическая связь имеет свой энергетический потенциал, оцениваемый как количество энергии на единицу массы вещества.. Это может быть дж/кг или ккал/моль Энергетическая разность химических связей начальных и конечных веществ реакции, по закону сохранения энергии компенсируется ростом тепловой составляющей в общем энергобалансе системы. Это в итоге приводит к разогреву вновь образованных продуктов сгорания..
2.5. Энтальпия топлива и продуктов сгорания.
Величиной, характеризующей уровень энергосодержания рабочего тела является его полная энтальпия, имеющая химическую и теплофизическую составляющие:
I= Iхим+ IQ
Из условия сохранения энергии следует, что если в замкнутой изолированной системе при ее переходе из состояния 1 в состояние 2 происходят внутренние преобразования энергии, без совершения работы, то полное энергосодержание такой системы остается постоянной, перераспределяясь между ее исходными составляющими т.е.:
I1 = I2 и I1хим+ I1Q= I2хим+ I2Q .
где I1 – полная энтальпия рабочей смеси (топлива и воздуха) перед началом горения.
I1= ∑(iхим+ iQ)=I1хим+ I1Q
Тепловая составляющая энтальпии I1Q определяется выражением:
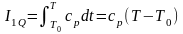
Ср – теплоемкость при постоянном давлении.
Т – текущая температура
Т0 - стандартная температура к которой приводятся теплота образования данного вещества из определенных «стандартных» веществ. Международным стандартом определено значение Т0= 298,15 К0.
I2 - полная энтальпия, образовавшихся в результате химической реакции продуктов сгорания, определяемая суммой их химических энергий и теплового эквивалента эффекта реакции:
I2= ∑(iхим+ iQ)=I2хим+ I2Q .
Таким образом, из условия I1 = I2 теплота, выделившаяся в результате химической реакции горения: Qр= I2Q - I1Q = I1хим - I2хим идет на нагрев продуктов сгорания, которым и надлежит совершить работу и передать часть своей энергии посредством механического преобразователя движителю транспортного средства.
Для совершения полезной работы должно происходить расширение газа. В тепловых двигателях расширение происходит в их рабочих органах: в соплах, сопловых аппаратах, рабочих цилиндрах, на лопатках турбин и т.д. При расчете двигателей обычно принимается, что зона химических реакций ограничена камерой сгорания, а при расширении изменяются только теплофизические параметры газовой смеси, т.е. за пределами камеры сгорания Iхим = const. Причем само расширение газа происходит при постоянной энтропии - (изоэнтропно). Совершаемая при этом единицей массы рабочего тела работа, определится разностью энергосодержаний газовых смесей после и до процесса расширения. Это положение следует из первого закона термодинамики:
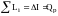 ,
,
где ∑Li – суммарная работа, совершаемая при расширении рабочего тела.
Полное энергосодержание потоков газа характеризуется энтальпией торможения, учитывающей кинетическую энергию его движения. Для газа в конце камеры сгорания (индекс 2) и на срезе сопла (индекс 3)можно записать:
 ;
;
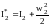 ;
;

Скорость газа в самой камере сгорания w2 по отношению к скорости w3 - истечения из сопла можно принять равной нулю (w2 ≈0). Тогда:

Скорость истечения газа при адиабатном процессе можно определить по известной из термодинамики зависимости:

Из данного выражения следует, что скорость истечения определяется теплотой сгорания топлива, которая зависит от свойств самого топлива и режимных условий: (параметры Т, R,k) и от конструктивных возможностей двигателя: степени расширения газов (р3/р2). Для современных воздушно-реактивных двигателей степень расширения газов не превышает значения 0.025…0.033.
