
- •Связь сн в альдегидной группе разрывается в реакциях окисления. Ненасыщенные и ароматические углеводородные радикалы, подвергающиеся атаке электрофильными или нуклеофильными реагентами.
- •Классификация
- •Физические свойства
- •Характерные химические реакции
- •Физические свойства
- •Свойства пептидной связи
- •Описание
- •Классификация липидов
- •Простые липиды
- •Оксилипиды
- •38. Жиры и масла. Особенности структуры. Извлечение из масличного сырья. Жирные кислоты. Эссенциальные жирные кислоты. Жиры и масла, общая характеристика
- •Эссенциальные жирные кислоты свойства и применение
- •Поливалентные углеводородные радикалы
- •41. Химические свойства моносахаридов. Реакции по гидроксильной и карбонильной группе. Химические свойства
- •Классификация гликозидов
- •Классификация полисахаридов
Физические свойства
Аминокислоты —
бесцветные кристаллические вещества,
хорошо растворимые в воде. Многие из
них обладают сл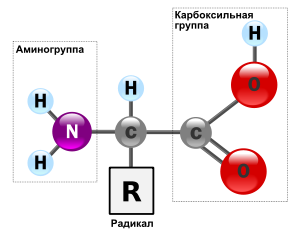 адким
вкусом.
адким
вкусом.
Общая структура α-аминокислот, составляющих белки (кроме пролина). Составные части молекулы аминокислоты — аминогруппа NH2, карбоксильная группа COOH, радикал (различается у всех α-аминокислот), α-атом углерода (в центре). Общие химические свойства
Все аминокислоты амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (хлороводородная соль глицина)
NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, т.е. находятся в состоянии внутренних солей.
NH2 —CH2COOH
![]() N+H3 —CH2COO-
N+H3 —CH2COO-
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина)
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
HOOC —CH2 —NH —H + HOOC —CH2 —NH2 → HOOC —CH2 —NH —CO —CH2 —NH2 + H2O
Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3+, а карбоксигруппа — в виде -COO−. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих амин Кислотно-основные превращения аминокислот в различных средах можно изобразить следующей общей схемой:

окислот трудно говорить о каком-то конкретном цвиттер-ионе.
32. Аминокислоты. Химические свойства. Реакции по аминогруппе, карбоксильной группе. Влияние структуры аминокислот на их поведение при нагревании. Реакции карбоксильной группы. 1. Образование солей с основаниями. Подобно алифатическим кислотам, аминокислоты образуют соли с основаниями.
Кроме обычных солей, они в известных условиях могут образовывать внутрикомплексные соли с катионами металлов. Очень характерны красиво кристаллизующиеся, интенсивно окрашенные в синий цвет внутрикомплексные соли аминокислот с медью:
 Большинство
реакций, в которые аминокислоты вступают
в лабораторных условиях (in
vitro), свойственны
всем аминам или карбоновым кислотам.
Большинство
реакций, в которые аминокислоты вступают
в лабораторных условиях (in
vitro), свойственны
всем аминам или карбоновым кислотам.
1. образование амидов по карбоксильной группе. При реакции карбонильной группы аминокислоты с аминогруппой амина параллельно протекает реакция поликонденсации аминокислоты, приводящей к образованию амидов. Чтобы предотвратить полимеризацию, аминогруппу кислоты блокируют с тем, чтобы в реакцию вступала только аминогруппа амина. С этой целью используют карбобензоксихлорид (карбобензилоксихлорид, бензилхлорформиат), трет-бутоксикарбоксазид и др. Для реакции с амином карбоксильную группу активируют, воздействуя на нее этилхлорформиатом. Защитную группу затем удаляют путем каталитического гидрогенолиза или действием холодного раствора бромистого водорода в уксусной кислоте.
2. образование амидов по аминогруппе. При ацилировании аминогруппы -аминокислоты образуется амид.
Реакция лучше идет в основной среде, так как при этом обеспечивается высокая концентрация свободного амина.
3. образование сложных эфиров. Карбоксильная группа аминокислоты легко этерифицируется обычными методами. Например, метиловые эфиры получают, пропуская сухой газообразный хлористый водород через раствор аминокислоты в метаноле:
Аминокислоты способны к поликонденсации, в результате которой образуется полиамид. Полиамиды, состоящие из -аминокислот, называются пептидами или полипептидами. Амидная связь в таких полимерах называется пептидной связью. Полипептиды с молекулярной массой не меньше 5000 называют белками. В состав белков входит около 25 различных аминокислот. При гидролизе данного белка могут образовываться все эти аминокислоты или некоторые из них в определенных пропорциях, характерных для отдельного белка.
Свойства корбоксильной группы (кислотность)
1. С основаниями → образуются соли:
NH2-CH2-COOH + NaOH → NH2-CH2-COONa + H2O
натриевая соль аминоуксусной кмслоты
2. Со спиртами → образуются сложные эфиры – летучие вещества (р. этерификации):
NH2-CH2-COOH + CH3OH HCl(газ)→ NH2-CH2-COOCH3 + H2O
метиловый эфир аминоуксусной кислоты
3. С аммиаком → образуются амиды:
NH2-CH(R)-COOH + H-NH2 → NH2-CH(R)-CONH2 + H2O
Свойства аминогруппы (основность)
1. С сильными кислотами → соли:
HOOC-CH2-NH2 + HCl → [HOOC-CH2-NH3]Cl
или HOOC-CH2-NH2*HCl
2. С азотистой кислотой (подобно первичным аминам):
NH2-CH(R)-COOH + HNO2 → HO-CH(R)-COOH + N2↑+ H2O
гидроксокислота
Измерение объёма выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка)
33. Особенности свойств альфа-аминокислот. Полипептиды. Пептидная связь. Пептидный синтез. Строение и свойства аминокислот
1. Общие структурные особенности аминокислот, входящих в состав белков
Общая структурная особенность аминокислот - наличие амино- и карбоксильной групп, соединённых с одним и тем же ?-углеродным атомом. R - радикал аминокислот - в простейшем случае представлен атомом водорода (глицин), но может иметь и более сложное строение.
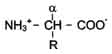
В водных растворах при нейтральном значении рН - аминокислоты существуют в виде биполярных ионов.
В отличие от 19 остальных ?-аминокислот, пролин - иминокислота, радикал которой связан как с ?-углеродным атомом, так и с аминогруппой, в результате чего молекула приобретает циклическую структуру.
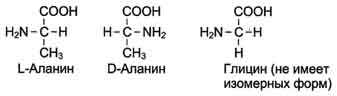
19 из 20 аминокислот содержат в ?-положении асимметричный атом углерода, с которым связаны 4 разные замещающие группы. В результате эти аминокислоты в природе могут находиться в двух разных изомерных формах - L и D. Исключение составляет глицин, который не имеет асимметричного ?-углеродного атома, так как его радикал представлен только атомом водорода. В составе белков присутствуют только L-изомеры аминокислот.
Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты.
Из двух аминокислот (1) и (2) образуется дипептид (цепочка из двух аминокислот) и молекула воды. По этой же схеме рибосома генерирует и более длинные цепочки из аминокислот: полипептиды и белки. Разные аминокислоты, которые являются «строительными блоками» для белка, отличаются радикалом R.
