
- •Связь сн в альдегидной группе разрывается в реакциях окисления. Ненасыщенные и ароматические углеводородные радикалы, подвергающиеся атаке электрофильными или нуклеофильными реагентами.
- •Классификация
- •Физические свойства
- •Характерные химические реакции
- •Физические свойства
- •Свойства пептидной связи
- •Описание
- •Классификация липидов
- •Простые липиды
- •Оксилипиды
- •38. Жиры и масла. Особенности структуры. Извлечение из масличного сырья. Жирные кислоты. Эссенциальные жирные кислоты. Жиры и масла, общая характеристика
- •Эссенциальные жирные кислоты свойства и применение
- •Поливалентные углеводородные радикалы
- •41. Химические свойства моносахаридов. Реакции по гидроксильной и карбонильной группе. Химические свойства
- •Классификация гликозидов
- •Классификация полисахаридов
25. Альдегиды и кетоны. Химические свойства. Нуклеофильные реакции по карбонильной группе. 2. Химические свойства.
Альдегиды и кетоны – один из наиболее реакционноспособных классов органических соединений. Их химические свойства определяются присутствием карбонильной группы. Вследствие большого различия в электроотрицательностях углерода и кислорода и высокой поляризуемости -связи связь С=О обладает значительной полярностью (С=О=2,5-2,8 D). Атом углерода карбонильной группы несет эффективный положительный заряд и является объектом для атаки нуклеофилов. Основной тип реакций альдегидов и кетонов – реакции нуклеофильного присоединения AdN. Кроме того, карбонильная группа оказывает влияние на реакционную способность связи С-Н в -положении, повышая ее кислотность.
Таким образом, молекулы альдегидов и кетонов содержат два основных реакционных центра – связь С=О и связь С-Н в -положении:

2.1. Реакции нуклеофильного присоединения.
Альдегиды и кетоны легко присоединяют нуклеофильные реагенты по С=О связи. Процесс начинается с атаки нуклеофила по карбонильному атому углерода. Затем образующийся на первой стадии тетраэдрический интермедиат присоединяет протон и дает продукт присоединения:

Активность карбонильных соединений в AdN–реакциях зависит от величины эффективного положительного заряда на карбонильном атоме углерода и объема заместителей у карбонильной группы. Электронодонорные и объемистые заместители затрудняют реакцию, электроноакцепторные заместители повышают реакционную способность карбонильного соединения. Поэтому альдегиды в AdN–реакциях активнее, чем кетоны.

Активность карбонильных соединений повышается в присутствии кислотных катализаторов, которые увеличивают положительный заряд на карбонильном атоме углерода:
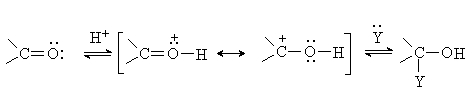
Альдегиды и кетоны присоединяют воду, спирты, тиолы, синильную кислоту, гидросульфит натрия, соединения типа NH2X. Все реакции присоединения идут быстро, в мягких условиях, однако образующиеся продукты, как правило, термодинамически не устойчивы. Поэтому реакции протекают обратимо, и содержание продуктов присоединения в равновесной смеси может быть низким. Химические свойства альдегидов и кетонов. Присоединение кислородных нуклеофилов
Двойная связь С=О, подобно связи С=С, представляет собой комбинацию - и -связей (они изоэлектронны). Однако, между этими двумя двойными связями имеются существенные различия:
- C=O значительно прочнее С=С;
- энергия связи С=О (179 ккал/моль) больше, чем энергия двух связей С-О (85.5 ккал/моль), в то время как энергия связи С=С (146 ккал/моль) меньше суммы энергий двух связей С-С (82.6. ккал/моль);
- связь С=О в отличие от С=С полярна.
При этом -связь поляризована сильнее, чем -связь. Таким образом, атом углерода карбонильной группы является электронодефицитным центром, а кислорода - электроноизбыточным.
Кроме тогo, карбонильная группа увеличивает кислотность атомов Н у соседнего атома С, приводя к увеличению кинетической кислотности (увеличению полярности связи С-Н из-за - I-эффекта карбонильной группы) и термодинамической кислотности (стабилизация образующегося карбаниона за счет мезомерного эффекта).
В молекулах карбонильных соединений имеется несколько реакционных центров.
Электрофильный центр карбонильный атом углерода, возникновение частичного положительного заряда на котором обусловлено полярностью связи С=О. Электрофильный центр участвует в реакциях нуклеофильного присоединения.
Основный центр атом кислорода с не поделенными парами электронов. С участием основного центра осуществляется кислотный катализ в реакциях присоединения, а также в процессе енолизации. Важно отметить, что альдегиды и кетоны являются жесткими основаниями Льюиса и координируются с жесткими кислотами: H+, BF3, ZnCl2, FeCl3 и т.д.
-СН-Кислотный центр, возникновение которого обусловлено индуктивным эффектом карбонильной группы. При участии СН-кислотного центра протекают многие реакции карбонильных соединений, в частности реакции конденсации.
Связь сн в альдегидной группе разрывается в реакциях окисления. Ненасыщенные и ароматические углеводородные радикалы, подвергающиеся атаке электрофильными или нуклеофильными реагентами.
26. Альдегиды и кетоны. Химические свойства. Реакции окисления, восстановления. Альдольно-кротоновая конденсация. Реакции окисления и восстановления
Реакции окисления и восстановления
Восстановление
Карбонильные соединения восстанавливаются до спиртов в результате каталитического гидрирования или под действием восстановителей, которые являются донорами гидрид-анионов.
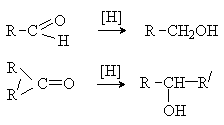
[H]: H2/кат., кат. – Ni, Pt, Pd;
LiAlH4; NaBH4 .
Восстановление карбонильных соединений комплексными гидридами металлов включает нуклеофильную атаку карбонильной группы гидрид-анионом. При последующем гидролизе образуется спирт.

Аналогично происходит восстановление карбонильной группы in vivo под действием кофермента НАД Н, который является донором гидрид-иона (см. лек. №19).
Окисление
Альдегиды окисляются очень легко практически любыми окислителями, даже такими слабыми, как кислород воздуха и соединения серебра (I) и меди (II).

Две последние реакции используются как качественные на альдегидную группу.
В присутствии щелочей альдегиды, не содержащие -водородных атомов диспропорционируют с образованием спирта и кислоты (реакция Канницаро).
2HCHO + NaOH HCOONa + CH3OH
Это является причиной того, что водный раствор формальдегида (формалин) при длительном хранении приобретает кислую реакцию.
Кетоны устойчивы к действию окислителей в нейтральной среде. В кислой и щелочной средах под действием сильных окислителей (KMnO4) они окисляются с разрывом связи С-С. Расщепление углеродного скелета происходит по двойной углерод-углеродной связи енольных форм карбонильного соединения, подобно окислению двойных связей в алкенах. При этом образуется смесь продуктов, содержащая карбоновые кислоты или карбоновые кислоты и кетоны.

Реакция альдольно-кротоновой конденсации, и ее оптимизация
Реакция альдольно-кротоновой конденсации и её оптимизация.
Реакциями конденсации обычно называют различные процессы уплотнения органических молекул, приводящие к образованию более сложных соединений в результате возникновения новых связей между атомами. В результате образуются вещество, содержащее одновременно альдегидную и спиртовую группы; оно было названо альдолем (сокращенное название от слова альдегидоалькоголь, т.е. альдегидоспирт), а конденсации карбонильных соединений, протекающая по такому пути и приводящая к веществам типа альдоля, называется реакцией альдольной конденсации. В альдольной конденсации могут участвовать и молекулы разных альдегидов и кетонов. Последние вступают в реакцию главным образом за счет атомов углерода и водорода, находящихся в -положении к их карбонильной группе; сама же карбонильная группа кетонов в этих реакциях значительно менее активна, чем карбонильная группа альдегидов.
Ал![]()
![]() ьдегид
и кетон альдоль кротоновый альдегид
ьдегид
и кетон альдоль кротоновый альдегид
В более или менее жестких условиях от продуктов этой реакции отщепляется вода и образуется непредельное оксосоединение (из ацетальадегида кротоновый альдегид), причем часто промежуточный оксиальдегид или оксикетон не может быть изолирован.

Реакция альдольной конденсации протекает по следующему механизму и катализируется основаниями (в качестве оснований обычно используют гидроксиды и алкоголяты щелочных металлов):

Катализ состоит в том, что ОН- вырывает Н+ из -звена оксосоединения, а полученный атом атакует карбонильный углерод другой молекулы.
При использовании слабых оснований реакция может оказаться существенно обратимой: пример конденсация ацетона под действием гидроксида бария:
Слабое основание гидроксид бария отрывает протон только от кислорода гидроксильной группы, что и приводит к расщеплению диацетонового спирта (4-гидрокси-4-метилпентанон-2) до ацетона. В данном случае образуется равновесная смесь, в которой содержание диацетонового спирта составляет всего 5% (чтобы осуществить синтез последнего с препаративным выходом, продукт конденсации периодически удаляют из реакционной смеси для этого применяют аппарат Сосклета). При действии сильным основанием (концентрированный раствор щелочи, карбид кальция) продукт альдольной конденсации сначала теряет протон метиленовой группы, а затем гидроксид-анион, т.е. дегидратируется, и необратимо переходит в непредельное карбонильное соединение:

б) при кислотном катализе ион водорода вызывает енолизацию одной молекулы оксосоединения и образование карбониего иона из второй:


Кривые стрелки в этих уравнениях означают сдвиг электронов, частично осуществляющийся в молекуле до реакции и завершающийся в реакции образованием новых связей с разрывом старых.
Если работать при низких температурах, то, как правило, нетрудно выделить простые альдоли. Альдоли, полученные из ароматических альдегидов, очень легко дегидратируются, так как при этом образуется достаточно длинная система сопряженных связей. Эта дегидратация особенно легко идет при кислотном катализе, но она идет и при щелочном катализе.
В противоположность другим альдегидам формальдегид может давать аддукты, в которых замещены все водородные атомы у -углерода метиленового компонента, например:

Это метилольное соединение очень легко вступает в перекрестную реакцию Канниццаро с образованием пентаэритрита.
Так же формальдегид вступает в реакцию, которую впервые осуществил А.М.Бутлеров в 1861 г.
Действуя на формальдегид Ca(OH)2, он получил густой сироп, оказавшийся смесью сахаристых веществ, содержащих гексозы.
Вначале молекула формальдегида взаимодействует с другой по типу реакции альдольной конденсации:
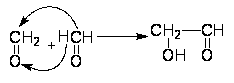
Далее эта молекула может вступать в аналогичную реакцию и в итоге получается смесь стереоизомеров гексоз.
Тем не менее, оказывается возможным заставить выступить альдегид в качестве метиленового компонента, если снизить карбонильную активность альдегида, предварительно превратив, переведя его в основание Шиффа и превратив последнее, например действием диизопропиламида лития, в соответствующий анион:

Самоконденсация такого аниона идет лишь в малой степени. Реакция с карбонильной группой других альдегидов или кетонов приводит к образованию N-аналогов альдолей, которые перегонкой с водяным паром в присутствии щавелевой кислоты можно перевести в ,-ненасыщенные альдегиды:

Легкость протекания кротоновой конденсации зависит также от электроноакцепторности карбонильной группы. В альдегидах она больше, и, следовательно, они легче вступают в кротоновую конденсацию, чем кетоны, и из них труднее получить соответствующие альдоли.
Интересно отметить, что в ,-непредельных карбонильных соединениях продуктах кротоновой конденсации влияние карбонильной группы эффективно передается через винильную группу. Особенно ярко это проявляется в случае альдегидов. По этой причине кротоновый альдегид подвергается дальнейшей конденсации, обусловленной протонной подвижностью атомов водорода метильной группы. Аналогичным образом ведут себя получающиеся далее непредельные альдегиды:

Следовательно, свойства соединений, в молекуле которых две группы, оказывают взаимное влияние, разделены винильным фрагментом, будут похожими на свойства соединений, где этого разделения нет. Это явление объясняется высокой эффективностью передачи электронного влияния через винильную группу и называется винилогией, а соответствующие соединения в данном случае альдегиды общей формулы СН3(СН=СН)nСНО, где n=0, 1, 2 и т.д. винилогами.
Альдегиды, как и кетоны симметричного строения, могут образовывать только один енолят и, следовательно, только один продукт самоконденсации, а несимметричные кетоны два енолята и, следовательно, два продукта самоконденсации:

Исключения составляют метилкетоны, отщепляющие при катализе основанием протон только от метильной группы. В результате их самоконденсации протекает однозначно:

Используя принцип альдольно-кротоновой конденсации, можно вводить в реакцию с альдегидам целый ряд соединений, обладающих С-Н-кислотностью. При этом не всегда можно провести четкую границу между этой реакцией и реакцией Кневенагеля.
При синтезе Перкина альдегиды взаимодействуют с ангидридами алифатических карбоновых кислот, причем образуются ,-ненасыщенные карбоновые кислоты. В качестве оснований, служащих конденсирующими средствами, используют щелочные соли карбоновых кислот или третичные основания (пиридин). Лучше всего идет реакция с ароматическими альдегидами, она приводит к образованию коричных кислот:

Конденсация формальдегида с уксусной кислотой с образованием акриловой кислоты также имеет значение в промышленности.
В жестких условиях в качестве метиленового компонента можно использовать также сложные эфиры карбоновых кислот. Они реагируют с ароматическими альдегидами и кетонами с образованием коричных кислот в присутствии алкоголятов щелочных металлов в качестве катализаторов. (По отношению к алифатическим кетонам сложные эфиры ведут себя как карбонильные компоненты).
Ацетонитрил может конденсироваться с кетонами и ароматическими альдегидами в условиях межфазного катализа в присутствии концентрированного раствора гидроксида калия.
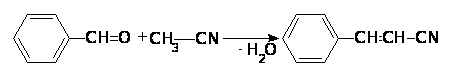
Более кислые сложные эфиры -хлорозамещенныех жирных кислот реагируют в роли метиленового компонента, как с альдегидами, так и с кетонами. При этом сначала образуется хлорогидрин, который в условиях реакции немедленно отщепляет хлороводород (реакция Дарзана-Кляйзена):
 (реакция
I)
(реакция
I)
Полученные таким способом 2,3-эпоксиэфиры (глицидные эфиры) при омылении декарбоксилируются и перегруппировываются в альдегиды:

В условиях межфазного катализа из хлороацетонитрила аналогично реакции I в присутствии гидроксида натрия можно получить 2,3-эпоксипропионитрилы.
В качестве других С-Н-кислотных соединений, реагирующих с альдегидами как метиленовые компоненты, можно назвать, например, - и -пиколины, а также циклопентадиен.
Иллюстрацией такого рода синтезов может служить получение кониина первого алкалоида, синтезированного Ладенбургом в 1886 г.

Из 2-метилпиридина и формальдегида через промежуточный 2-гидроксиэтилпиридин в промышленности получают мономер 2-винилпиридин.
При синтезе алкилпиридинов в промышленности промежуточными стадиями также являются реакции альдольно-кротоновой конденсации, связанные с образованием иминов и дегидрированием. Так, из ацетальальдегида и аммиака над Al2O3 при 450оС образуется смесь - и -пиколина, конденсация чрезвычайно многогранна, в тех же условиях в присутствии формальдегида получают пиридин и -пиколин, причем последний можно окислить далее до никотиновой кислоты.
Как показывают эти примеры, адольно-кротоновая и имеет важное препаративное значение для создания связей С-С.
27. Карбоновые кислоты. Строение молекул. Многообразие карбоновых кислот. Номенклатура. Физические свойства. Характеристика общих химических свойств. Карбо́новые кисло́ты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH. Кислые свойства объясняются тем, что данная группа может сравнительно легко отщеплять протон. За редкими исключениями карбоновые кислоты являются слабыми. Например, у уксусной кислоты CH3COOH константа кислотности равна 1,75·10−5. Ди- и трикарбоновые кислоты более сильные, чем монокарбоновые. Номенклатура
По международной номенклатуре ИЮПАК, карбоновые кислот называют, выбирая за основу наиболее длинную углеродную цепочку, содержащую группу -СООН, и добавляя к названию соответствующего углеводорода окончание "овая" и слово "кислота". При этом атому углерода, входящему в состав карбоксильной группы, присваивается первый номер. Например СН3-СН2-СООН - пропановая кислота, СН3-С(СН3)2-СООН - 2,2-диметилпропановая кислота. По рациональной номенклатуре к названию углеводорода добавляют окончание "карбоновая" и слово "кислота", не включая при этом в нумерацию цепи атом углерода карбоксильной группы. Например, С5Н9СООН - циклопентанкарбоновая кислота, СН3-С(СН3)2-СООН - трет-бутилкарбоновая кислота. Многие из карбоновых кислот имеют тривиальные названия (некоторые из них приведены в таблице).
Формула |
Название по ИЮПАК |
Тривиальное название |
НСООН |
метановая кислота |
муравьиная кислота |
СН3-СООН |
этановая кислота |
уксусная кислота |
СН3-СН2-СООН |
пропановая кислота |
пропионовая кислота |
СН3-(СН2)2-СООН |
бутановая кислота |
масляная кислота |
СН3-(СН2)3-СООН |
пентановая кислота |
валериановая кислота |
СН3-(СН2)4-СООН |
гексановая кислота |
капроновая кислота |
СН3-(СН2)5-СООН |
гептановая кислота |
энантовая кислота |
СН3-(СН2)6-СООН |
октановая кислота |
каприловая кислота |
СН3-(СН2)7-СООН |
нонановая кислота |
пеларгоновая кислота |
СН3-(СН2)8-СООН |
декановая кислота |
каприновая кислота |
СН3-(СН2)9-СООН |
ундекановая кислота |
ундециловая кислота |
СН3-(СН2)10-СООН |
додекановая кислота |
лауриновая кислота |
СН3-(СН2)11-СООН |
тридекановая кислота |
тридециловая кислота |
СН3-(СН2)12-СООН |
тетрадекановая кислота |
миристиновая кислота |
СН3-(СН2)13-СООН |
пентадекановая кислота |
пентадециловая кислота |
СН3-(СН2)14-СООН |
гексадекановая кислота |
пальмитиновая кислота |
СН3-(СН2)15-СООН |
гептадекановая кислота |
маргариновая кислота |
СН3-(СН2)16-СООН |
октадекановая кислота |
стеариновая кислота |
СН3-(СН2)17-СООН |
нонадекановая кислота |
стеариновая кислота |
С6Н5-СООН |
бензолкарбоновая кислота |
бензойная кислота |
СН2=СН-СООН |
пропеновая кислота |
акриловая кислота |
СН≡С-СООН |
пропиновая кислота |
пропиоловая кислота |
СН3-С(СН3)2-СООН |
2,2-диметилпропановая |
пивалиновая кислота |
