
Электродвижущие силы
Известно, что причиной возникновения электрического тока является электродвижущая сила (ЭДС). За меру ЭДС принимают разность потенциалов соприкасающихся тел.
Для возникновения ЭДС необходимо два электрода из различных металлов (гальваническая пара) погрузить в растворы солей тех же металлов и обеспечить контакт между электродами и растворами. Такая система будет называться гальваническим элементом. При этом на границе каждого из электродов с раствором возникает двойной электрический слой. Одна часть этого слоя находится на поверхности электрода, а вторая – в жидкости, прилегающей к нему. На границе металл – жидкость возникает равновесная разность потенциалов, называемая электродным потенциалом.

Расположение ионов в двойном электрическом слое
Двойной электрический слой состоит из двух частей:
Неподвижного слоя ионов, расположенных в пленке жидкости, смачивающей поверхность электрода (не движется при перемещении жидкости относительно неподвижного электрода);
Подвижного (диффузного) слоя, перемещающегося с жидкостью при движении.
Электродный потенциал Е на границе металл – раствор является суммой двух слагаемых:
Е = +
- потенциал между пластинкой металла и неподвижным слоем ионов; - потенциал между неподвижным слоем ионов и подвижным (возникает при движении жидкости относительно твердой поверхности).
Электродные потенциалы возникают в результате растворения (отрыва ионов, входящих в кристаллическую решетку, от поверхности под действием диполей воды). Растворимость зависит от природы металла и температуры. Для данного металла при одинаковой температуре она постоянна.
Примером гальванического элемента является элемент Якоби – Даниэля. Он состоит из цинкового и медного электродов, погруженных соответственно в растворы сульфата цинка и сульфата меди. Форма записи элемента следующая:
(+)Cu CuSO4 ZnSO4 Zn(-)
Одной чертой показана граница раздела фаз между металлом и раствором соли, двумя – между растворами двух солей. Еще при разомкнутых электродах между электродами и растворами солей возникают равновесные потенциалы. Потенциал цинковой пластинки благодаря появлению на ней избытка электронов, отрицателен (Е 0), потенциал медной пластики в результате осаждения на ней некоторого количества положительно заряженных ионов меди положителен (Е 0).
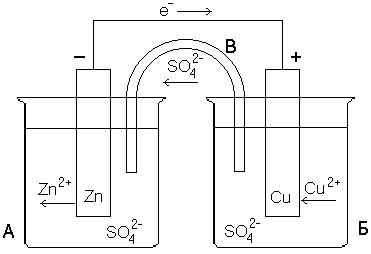
При соединении электродов металлическим проводником избыточные электроны с цинковой пластинки начнут переходить на медную, т.е. между цинком и медью во внешней цепи возникает электрический ток. При этом непрерывно протекают следующие процессы:
Сu2+ + 2e- Cu0
Zn0 – 2e- Zn2+
Cуммарно Zn + CuSO4 Cu + ZnSO4
Если периодически менять расходуемый при работе раствор сульфата меди и цинковый электрод, можно получать ток продолжительное время.
Равновесный электродный потенциал. Уравнение Нернста
Величина равновесного электродного потенциала зависит от природы металла, из которого изготовлен электрод, температуры и концентрации ионов в растворе соли. Зная эти величины, можно вычислить электродный потенциал по формуле (уравнение Нернста):

n – число электронов, которое теряет атом металла, превращаясь в ион или приобретает ион металла при восстановлении (равно валентности металла в данном соединении), R – газовая постоянная, F – постоянная Фарадея, С – концентрация ионов металла в данном растворе, г-ион/л; Е0 – нормальный (стандартный) электродный потенциал.
При подстановке в уравнение числовых величин R, F и учете модуля перехода от натурального логарифма к десятичному, получим:
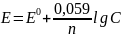
Величина Е0 представляет собой электродный потенциал данного металла, погруженного в раствор, в котором концентрация ионов металла равна 1 г-ион/л (или активность иона металла равна 1).
Величины стандартных электродных потенциалов определяют опытным путем. Для этого составляют гальваническую цепь из исследуемого электрода и электрода сравнения, потенциал которого точно известен. Измеряют ЭДС составленной цепи. Она в основном определяется разностью электродных потенциалов:
Е = Еисслед – Еэл.ср.
В качестве электродов сравнения используют водородный или каломельный электроды.
Водородный электрод устроен следующим образом: платиновую пластинку, электролитически покрытую слоем платины (платиновой чернью), погружают в раствор серной кислоты, содержащий ионы Н+ в количестве 1 г-ион/л раствора. Через раствор пропускают струю чистого водорода под нормальным давлением. При этом водород в большом количестве поглощается платиной, вследствие чего поверхность пластинки покрывается пленкой из газообразного водорода. Равновесный электродный потенциал устанавливается на границе: газообразный водород на пластинке – ион водорода в растворе. Схему водородного электрода можно записать так: PtН2Н+.
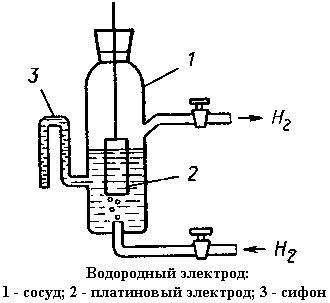
Потенциал стандартного водородного электрода условно принят за ноль.
