
Тема 1.8. Электрохимия
Электрохимия – раздел ФХ, изучающий закономерности взаимных превращений электрической и химической энергии. Электрохимия рассматривает:
- электрическую проводимость растворов;
- работу гальванических элементов;
- процессы электролиза.
По электрической проводимости тока все вещества делятся на проводники, полупроводники и изоляторы (диэлектрики). Различают проводники I и II рода.
К проводникам I рода относят все металлы и сплавы, а также графит. Их электрическая проводимость обусловлена наличием в кристаллических решетках свободных и слабо связанных электронов (электронная проводимость), она не сопровождается переносом вещества и не влечет за собой химического превращения материала, из которого сделан проводник. При повышении температуры электрическая проводимость металлов снижается, а сопротивление возрастает, т.к. упорядоченному движению электронов мешает усиливающееся тепловое движение частиц в кристаллической решетке.
К проводникам II рода относят растворы и расплавы электролитов. перенос электричества в них осуществляется ионами электролита (ионная проводимость), в результате чего наблюдается химическое разложение вещества. С повышением температуры электрическая проводимость таких проводников увеличивается, поскольку уменьшается вязкость среды, в которой перемещаются ионы, возрастает скорость их передвижения к электродам.
Проводники II рода обладают намного меньшей проводимостью по сравнению с проводниками I рода. Основные электрохимические процессы протекают на границах раздела фаз между проводниками I и II рода.
Удельная и эквивалентная электрическая проводимость растворов
Электрической проводимостью называют способность веществ пропускать электрический ток под действием электрического напряжения. Электрическая проводимость – величина, обратная сопротивлению (1/R). Единица измерения – сименс (См) – электрическое проводимость проводника сопротивлением 1 Ом.
Сопротивление проводника:
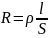
l – длина проводника; S –площадь поперечного сечения; - удельное сопротивление, т.е. сопротивление столбика вещества длиной 1 м при поперечном сечении 1 м2.
Величину, обратную удельному сопротивлению, называют удельной проводимостью ϰ:
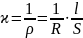
Удельной электрической проводимостью проводников второго рода называется электрическая проводимость 1 м3 раствора, заключенного между платиновыми электродами с поверхностью 1 м2, находящимися на расстоянии 1 м друг от друга.
С повышением температуры электрическая проводимость увеличивается примерно на 2% на каждый градус.
По мере разбавления концентрированных растворов электрическая проводимость их сначала растет, достигает при некоторой концентрации максимального значения, а затем начинает падать. Объясняется это тем, что в случае сильных электролитов в начальные периоды разбавления ослабляются межионные электрические взаимодействия и увеличивается скорость движения ионов. При дальнейшем разбавлении начинается заметно проявляться общее уменьшение концентрации электролита.
Наибольшую электрическую проводимость имеют растворы сильных кислот и щелочей.
Эквивалентной электрической проводимостью называют проводимость столба раствора, содержащего 1 кг-экв электролита, заключенного между электродами, находящимися на расстоянии друг от друга 1 м.
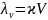
Число кубических метров раствора (V), в котором заключается 1 кг-экв растворенного электролита, называют разведением раствора (м3/кг-экв). Размерность λv Cмм2кг-экв-1.
Разведение – величина, обратная концентрации раствора V = 1/C. Отсюда:
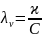
С – концентрация, выраженная числом килограмм-эквивалентов вещества в 1 м3 раствора.
Эквивалентная электрическая проводимость непрерывно увеличивается с ростом температуры.
Зависимость электростатической проводимости от концентрации растворов однотипна для всех электролитов. По мере разбавления раствора расстояние между ионами увеличивается, силы взаимодействия уменьшаются, растет скорость перемещения ионов и эквивалентная электрическая проводимость. Разбавление в данном случае не сказывается, т.к. всякий раз учитывается весь объем раствора, содержащего 1 кг-экв вещества, независимо от того, насколько разбавлен раствор. При бесконечно большом разбавлении λv достигает наибольшего значения (λ∞), во всех остальных случаях λv λ∞.
Отношение λv/λ∞:
- у сильных электролитов называют коэффициентом электрической проводимости fv (кажущейся степенью диссоциации);
- у слабых электролитов – истинным значением степени диссоциации электролита в растворе .
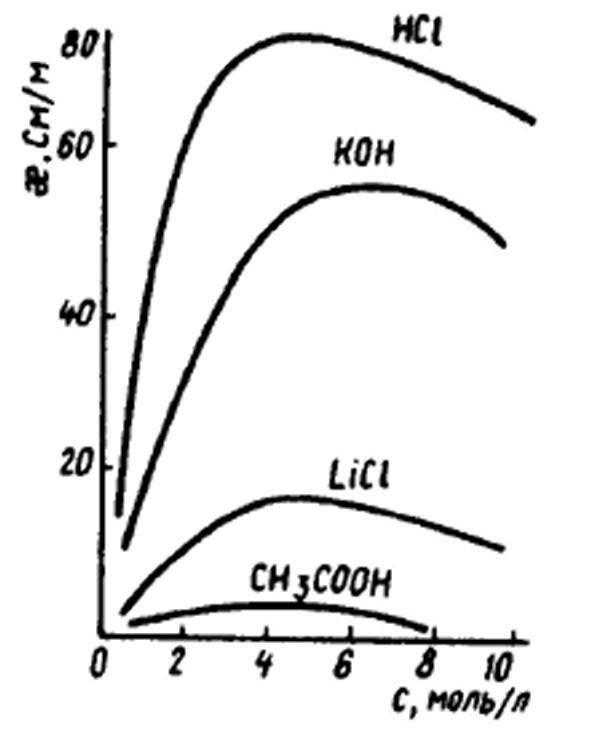
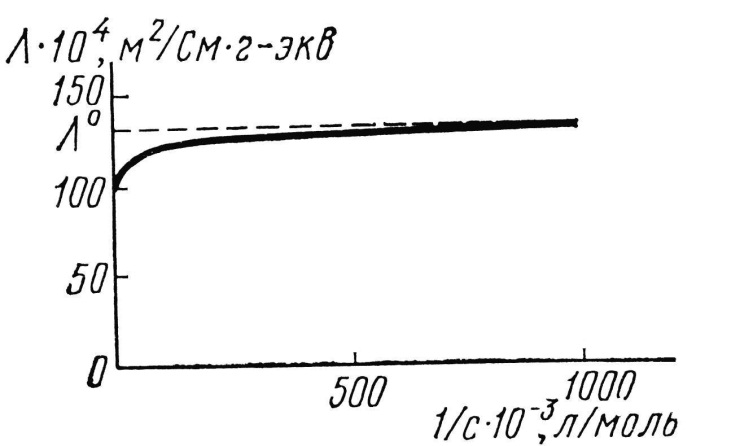
Зависимость удельной электрической проводимости от концентрации растворов |
Зависимость эквивалентной электрической проводимости от концентрации растворов |
Скорость и подвижность ионов. Закон Кольрауша
Электрический ток в растворах электролитов переносят ионы. От скорости их перемещения к электродам зависит электрическая проводимость раствора.
Скорость перемещения ионов зависит от:
- их природы;
- природы растворителя;
- температуры раствора;
- концентрации раствора.
Скорости движения ионов чрезвычайно малы по сравнению со скоростями движения молекул в газах. Это связано с более высокой вязкостью среды, тормозящим влиянием ионов противоположного знака, гидратацией (сольватацией) ионов. Величина скорости будет изменяться в зависимости от разности потенциалов, приложенной к электродам. Поэтому абсолютными скоростями ионов называют их скорости Uа и Uк, выраженные в м/с, при разности потенциалов в 1 В на 1 м длины [м2/(сВ)].
Вместо величин абсолютных скоростей удобнее пользоваться пропорциональными им величинами подвижностей:
lк = FUк lа= FUа
где F – постоянная Фарадея, F = 9,65107 Кл/кг-экв.
Для многовалентных ионов подвижность относят к единице заряда и обозначают l1/2Ca2+, l1/3Al3+.
Наибольшей подвижностью обладают ионы Н+ и ОН-.
С повышением температуры подвижность ионов сильно увеличивается в связи с уменьшением вязкости среды и степени гидратации ионов.
Скорость и подвижность ионов связана с их размерами и массой, а также природой растворителя. С увеличением концентрации растворов вследствие усиления тормозящего электростатического действия ионов друг на друга подвижность и электрическая проводимость уменьшается.
Закон Кольрауша: эквивалентная электрическая проводимость электролитов при бесконечно большом разбавлении при постоянной температуре определяется только суммой эквивалентных электрических проводимостей (подвижностей) катиона и аниона, т.е.
λ∞ = λк + λа
λ∞ = F(Uк + Uа)
Uа и Uк – предельное значение абсолютных скоростей движения аниона и катиона при бесконечно больших разбавлениях.
Закон неприменим к концентрированным растворам, перестает быть точным при концентрациях 0,01-0,05 н.
Найдя расчетным путем λ∞ и определив на опыте эквивалентную электрическую проводимость при данном (конечном) разбавлении λv, можно вычислить значение истинной или кажущейся (для сильных электролитов) диссоциации (наиболее распространенный и надежный метод).
Измерение электрической проводимости электролитов и ее практическое применение
Электрическую проводимость растворов используют для решения целого ряда теоретических и практических задач, например, для определения степени диссоциации и константы диссоциации К слабых электролитов, вычисления растворимости труднорастворимой соли и произведения растворимости. На основе измерения электрической проводимости при проведении физико-химического анализа можно делать заключение о характере взаимодействия компонентов в смесях различного состава.
Электрическую проводимость измеряют методом кондуктометрии. Широкое распространение получило кондуктометрическое титрование.
Явление электролиза
Электролизом называют химическое разложение веществ под влиянием электрического тока, сопровождающееся выделением на электродах продуктов разложения и побочными явлениями.
Электролиз осуществляют в специальных сосудах – электролизерах, которые заполняют раствором или расплавом электролита. В электролит помещают два электрода, соединенные с положительным (анод) и отрицательным (катод) полюсами источника постоянного тока.
Электрический ток в электролите представляет собой процесс движения ионов к электродам. Катионы – положительно заряженные ионы металлов и водорода – передвигаются к катоду; анионы – отрицательно заряженные ионы кислотных остатков и ОН- - к аноду. При достижении электродов ионы нейтрализуются и, превращаясь в атомы или молекулы, выделяются на них. Во внешней цепи при этом непрерывно перемещаются электроны от анода к катоду.
Электролиз безводного хлорида магния:
на катоде:
Mg2+ + 2e- = Mg0
на аноде:
2Cl- - 2e- = 2Cl0 (первичный процесс)
2Cl0 = Cl2 (вторичный процесс)
Следовательно, электролиз представляет собой электронный процесс окисления – восстановления ионов электролита за счет электрической энергии с выделением на электродах электрически нейтральных частиц.
