
- •2. Будова атомів
- •Зв'язок між положенням хімічного елемента у періодичній системі та електронною будовою його атомів
- •3. Хімічний зв‘язок
- •Типи хімічного зв’язку
- •Ковалентний зв’язок
- •Гібридизація ао
- •Типи гібридизації
- •Типи молекул
- •Молекули з кратними зв’язками
- •Йонний зв’язок
- •Міжмолекулярна взаємодія. Водневий зв'язок
- •Тверді речовини. Кристалічний стан речовин
- •4. Класи неорганічних сполук
- •Хімічні властивості оксидів.
- •Розділ іі. Закономірності перебігу хімічних реакцій
- •5. Хімічна термодинаміка
- •6. Хімічна кінетика та рівновага Хімічна кінетика
- •Хімічна рівновага
- •7. Природа розчинів та способи вираження їх складу
- •8. Властивості розчинів неелектролітів
- •Отже, обидва розчини киплять за однакової температури (100,52 0с) та замерзають за однакової температури (-1,86 0с).
- •9. Розчини електролітів
- •Кількісні характеристики процесу дисоціації
- •Класифікація електролітів за характером утворених йонів
- •Дисоціація води
- •Реакції обміну в розчинах електролітів
- •І. Гідроліз солі, утвореної сильною основою і слабкою кислотою
- •Іі. Гідроліз солі, утвореної слабкою основою та сильною кислотою
- •Висновки:
- •Кількісні характеристики процесу гідролізу солей
- •Класифікація окисно-відновних реакцій
- •10. ГальванічНі елементи
- •Типи електродів
- •Концентраційні гальванічні елементи
- •11. Напрямок перебігу окисно-відновних реакцій
- •12. Корозія металів та сплавів
- •13. Електроліз
- •Катодні процеси.
- •Анодні процеси
- •Додаток
- •5. Григор`єва в.В., Самійленко в.М., Сич а.М. Загальна хімія: Підручник – к.: Вища шк., 1991. – 431 с., isbn 5-11-003667-5.
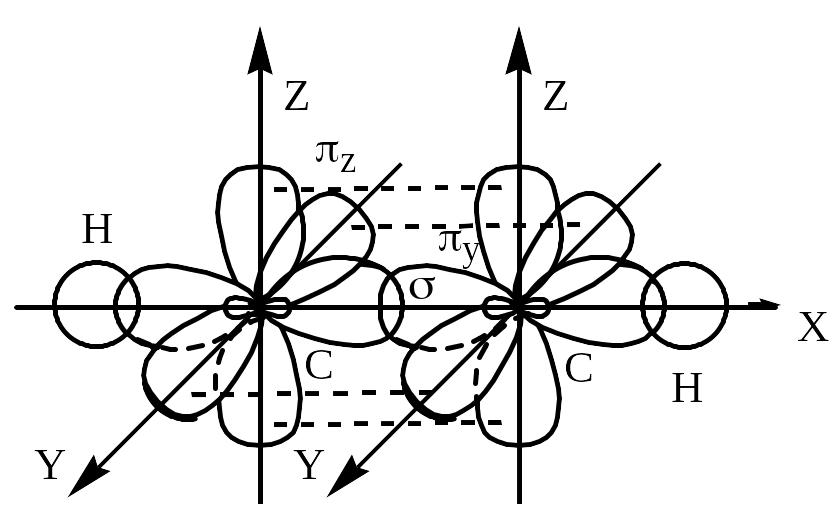
Молекули з кратними зв’язками
Приклад 2. Наведіть схему перекривання електронних хмар атомів в молекулі ацетилену С2Н2.
Розв’язання.
Складаємо електронну конфігурацію атома карбону у нормальному стані, а також наведемо структурну формулу молекули С2Н2:
С 1s22s22p1xp1ypz Н–СС–Н
В структурній формулі кожна спільна електронна пара, тобто кожний хімічний зв’язок між атомами, зображений рискою. Число хімічних зв’язків, які утворює атом карбону (один – з атомом гідрогену і три – з іншим атомом карбону), вказує на його валентність. Отже, атом карбону в молекулі С2Н2 є чотирьохвалентним і знаходиться у збудженому стані, в якому число неспарених електронів відповідає його валентності: С* 1s22s12р1xp1yp1z
Між атомами карбону здійснюється потрійний зв’язок, який поєднує три зв`язки, але їх природа різна: один зв’язок є -зв’язком, два інші – -зв’язками.
Оскільки -зв’язки утворюються негібридними р-АО, тому дві р-АО (ру- та рz-АО) кожного атома карбону не беруть участь в гібридизації АО і їх електронні хмари зберігають форму об’ємної вісімки. Два - зв’язки між атомами карбону здійснюються внаслідок перекривання р-електронних хмар, розташованих у двох взаємно перпендикулярних площинах.
Отже, в гібридизації беруть участь тільки дві АО кожного атома карбону, а саме 2s-АО та 2рх-АО. В цьому випадку відбувається sр-гібридизація АО.
Дві гібридні електронні хмари кожного атома карбону розташовані під кутом 1800. Відбувається їх перекривання між собою та з s-електронними хмарами двох атомів гідрогену. Отже, молекула ацетилену має лінійну будову.
Йонний зв’язок
Властивості йонного зв’язку
Йонний зв’язок здійснюється тоді, коли взаємодіють атоми елементів, електронегативності яких різко відрізняються між собою (χ>2), тобто в сполуках лужних та лужноземельних металів з оксигеном та галогенами (флуором, хлором, бромом та йодом).
Характерними властивостями йонного зв’язку є його ненапрямленість та ненасиченість.
Йони можна розглядати як заряджені кульки, силові поля яких рівномірно розподіляються у просторі в усіх напрямках. Тому певний йон взаємодіє з йонами протилежного знаку у будь-якому напрямку. В цьому полягає ненапрямленість йонного зв’язку.
Ненасиченість йонного зв’язку пояснюється тим, що число цих йонів, з якими взаємодіє певний йон, залежить лише від розмірів йонів і не залежить від електронної будови атомів елементів.
Внаслідок ненапрямленості та ненасиченості йонного зв`язку кожний йон оточений максимальним числом йонів протилежного знаку. Це означає, що при сполученні йонів утворюються не певні молекули, а великі агрегати – йонні кристали, що складаються з великого числа йонів.
Міжмолекулярна взаємодія. Водневий зв'язок
При вивченні властивостей речовин поряд з хімічними зв`язками між атомами в молекулах слід враховувати і взаємодію між молекулами речовин, тобто міжмолекулярну взаємодію. Розрізняють такі складові міжмолекулярної взаємодії: орієнтаційну, індукційну та дисперсійну.
Орієнтаційна або диполь-дипольна взаємодія - це сили притягання між протилежно зарядженими полюсами полярних молекул, наприклад, між молекулами Н2O або між молекулами НСl:

Полярність
молекули визначається електричним
моментом диполя μ=q·l,
де q - заряд полюса диполя, а l
- відстань між його полюсами. Чим більший
![]() ,
тим міцнішою є орієнтаційна взаємодія
між молекулами.
,
тим міцнішою є орієнтаційна взаємодія
між молекулами.
Під час взаємодії полярних та неполярних молекул під впливом полярних молекул відбувається поляризація неполярних, тобто неполярні молекули перетворюються на полярні, і між такими молекулами виникають сили притягання, які називаються індукційною взаємодією:
Якщо молекули неполярні, то між ними відсутні орієнтаційна та індукційна взаємодії. Але такі речовини, як, наприклад, інертні гази, що складаються з неполярних молекул, здатні існувати і у рідкому, і у твердому стані. Це свідчить про наявність сил притягання між неполярними молекулами, що пояснюється так. Внаслідок безперервного руху електронів можливе зміщення електронної хмари молекули відносно атомних ядер, що коливаються. Утворюється маленький диполь, який існує дуже короткий час, але впливає на сусідню молекулу, викликаючи її поляризацію. Сили притягання, які виникають між різнойменними полюсами маленьких миттєвих диполів, називаються дисперсійною взаємодією:
Дисперсійна взаємодія є універсальною, тобто діє між будь-якими молекулами.
Висновки:
І. Міжмолекулярна взаємодія має електростатичну природу.
2. Міжмолекулярна взаємодія зумовлює конденсацію газів, тобто перетворення їх у рідину, а також перетворення рідини на тверду речовину.
З. Між полярними молекулами існують всі три види міжмолекулярної взаємодії, між полярними та неполярними - індукційна та дисперсійна взаємодії, а між неполярними молекулами існує тільки дисперсійна взаємодія.
4. Міжмолекулярна взаємодія відрізняється від ковалентного зв'язку відсутністю напрямленості та насиченості, а також тим, що виникає на значно більших відстанях, ніж хімічний зв`язок між атомами в молекулах.
5. Міжмолекулярна взаємодія набагато слабкіша за ковалентний зв'язок. Так, наприклад, кількість енергії, необхідної для дисоціації молекул Сl2 на атоми, тобто енергії, необхідної для руйнування ковалентного зв'язку між атомами в молекулах Сl2, дорівнює 243 кДж/моль. А кількість енергії, необхідної для відриву молекул Сl2 одна від одної у кристалі, тобто енергії руйнування міжмолекулярної взаємодії, дорівнює 25 кДж/моль.
6. Величину міжмолекулярної взаємодії можна охарактеризувати за допомогою температури плавлення та температури кипіння. Чим більша молярна маса однотипних речовин, тим міцнішою є міжмолекулярна взаємодія, тим більшу кількість енергії потрібно витратити для того, щоб відірвати молекули одну від одної і перевести речовину з твердого стану до рідкого, а з рідкого до газуватого. Тому із збільшенням молярної маси речовин підвищується іх температура плавлення та температура кипіння.
Наприклад:
Формула речовини |
HF |
HCl |
HBr |
HI |
M, г/моль |
20 |
36,5 |
81 |
128 |
Температура кипіння, 0С |
+19,5 |
-85 |
-67 |
-35,4 |
Отже, у ряду НСl - НВr - НІ, а також у ряду H2S - H2Se - H2Те спостерігається підвищення температур плавлення та кипіння. Однак, речовини HF та Н2O плавляться та киплять за аномально високих температур, що свідчить про існування додаткових сил притягання між їх молекулами. Це пояснюється на прикладі речовини HF. При утворенні ковалентного полярного зв'язку між атомом гідрогену та атомом флуору у молекулі HF відбувається зміщення електронної хмари зв`язку до атома флуору. На найелектронегативнішому атомі флуору з'являється значний ефективний негативний заряд "-", а атом гідрогену майже лишається електронної хмари і набуває ефективного позитивного заряду "+". Між атомом гідрогену та атомом флуору сусідньої молекули HF виникають сили притягання, які називаються водневим зв'язком:
![]()
Утворення водневого зв'язку обумовлено тим, що атоми гідрогену позбавлені електронів і не відштовхуються атомами з ефективним негативним зарядом, що містяться в сусідній молекулі. Крім того, завдяки дуже малим розмірам, атоми гідрогену здатні глибоко проникати в електронну оболонку інших атомів.
Водневий зв'язок є найбільш характерним для сполук гідрогена з флуором, оксигеном та у меншій мірі - з нітрогеном, тобто з атомами найбільш електронегативних елементів. Тільки тоді відбувається значне зміщення електронноі хмари зв`язку від атомів гідрогену до атомів вказаних елементів.
Отже, водневий зв'язок - це сили притягання між атомами гідрогену та атомами найбільш електронегативних елементів, якщо ці атоми між собою ковалентно не зв'язані.
Утворення водневого зв'язку викликає об’єднання молекул в агрегати, наприклад, (HF)6. Внаслідок утворення водневого зв'язку молекули H2O асоційовані, і вода має ажурну просторову структуру, в якій кожний атом оксигену розміщений у центрі тетраедра, вершини якого займають атоми гідрогену.
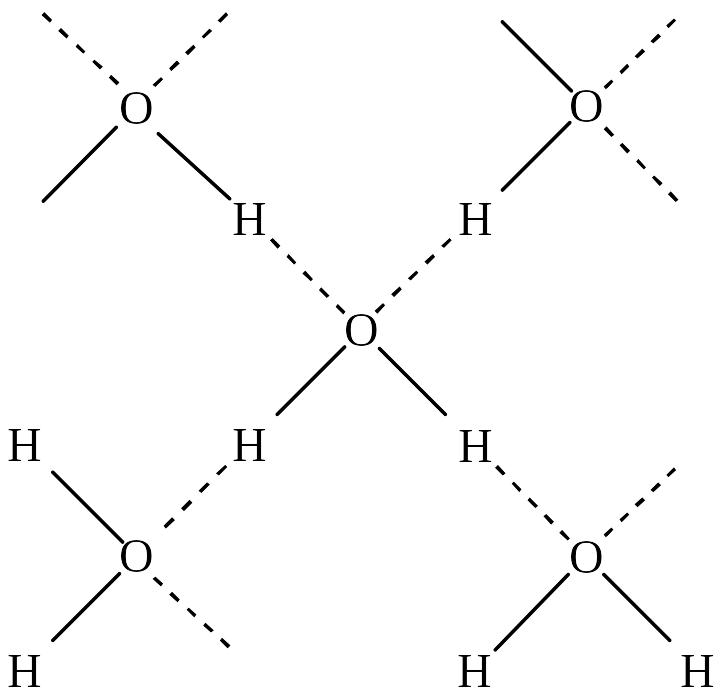
Підвищення температури плавлення та температури кипіння таких сполук пояснюється додатковою кількістю енергії, яка необхідна для того, щоб розщепити ці агрегати на молекули перед переходом речовини з твердого стану до рідкого та газуватого.
Водневий зв'язок може виникати не тільки між атомами різних молекул, а й в межах однієї молекули. Наприклад:
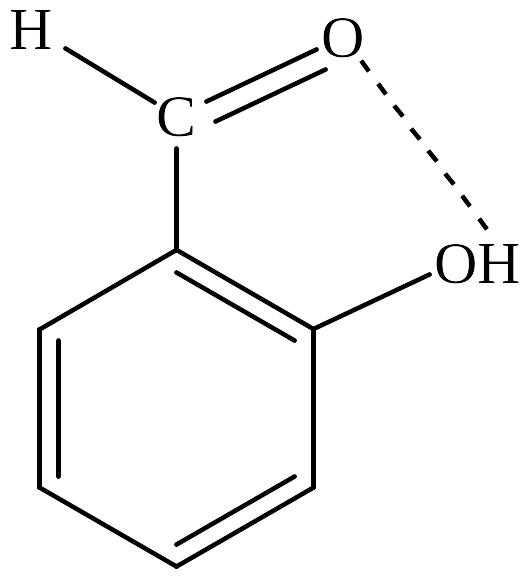
Водневий зв'язок міцніший за міжмолекулярну взаємодію, але набагато слабкіший за ковалентний та йонний зв'язки.
