
- •2. Будова атомів
- •Зв'язок між положенням хімічного елемента у періодичній системі та електронною будовою його атомів
- •3. Хімічний зв‘язок
- •Типи хімічного зв’язку
- •Ковалентний зв’язок
- •Гібридизація ао
- •Типи гібридизації
- •Типи молекул
- •Молекули з кратними зв’язками
- •Йонний зв’язок
- •Міжмолекулярна взаємодія. Водневий зв'язок
- •Тверді речовини. Кристалічний стан речовин
- •4. Класи неорганічних сполук
- •Хімічні властивості оксидів.
- •Розділ іі. Закономірності перебігу хімічних реакцій
- •5. Хімічна термодинаміка
- •6. Хімічна кінетика та рівновага Хімічна кінетика
- •Хімічна рівновага
- •7. Природа розчинів та способи вираження їх складу
- •8. Властивості розчинів неелектролітів
- •Отже, обидва розчини киплять за однакової температури (100,52 0с) та замерзають за однакової температури (-1,86 0с).
- •9. Розчини електролітів
- •Кількісні характеристики процесу дисоціації
- •Класифікація електролітів за характером утворених йонів
- •Дисоціація води
- •Реакції обміну в розчинах електролітів
- •І. Гідроліз солі, утвореної сильною основою і слабкою кислотою
- •Іі. Гідроліз солі, утвореної слабкою основою та сильною кислотою
- •Висновки:
- •Кількісні характеристики процесу гідролізу солей
- •Класифікація окисно-відновних реакцій
- •10. ГальванічНі елементи
- •Типи електродів
- •Концентраційні гальванічні елементи
- •11. Напрямок перебігу окисно-відновних реакцій
- •12. Корозія металів та сплавів
- •13. Електроліз
- •Катодні процеси.
- •Анодні процеси
- •Додаток
- •5. Григор`єва в.В., Самійленко в.М., Сич а.М. Загальна хімія: Підручник – к.: Вища шк., 1991. – 431 с., isbn 5-11-003667-5.
Ковалентний зв’язок
Властивості ковалентного зв’язку
Насиченість ковалентного зв’язку пояснюється тим, що число ковалентних зв’язків, які утворює певний атом, обмежується числом неспарених електронів. Тобто атом, який містить один неспарений електрон, утворює з неспареним електроном іншого атома одну спільну електронну пару, отже, один хімічний зв’язок. Атом з двома неспареними електронами утворює дві спільні електронні пари, тобто два хімічних зв’язки тощо.
Напрямленість ковалентного зв’язку полягає в тому, що хімічний зв’язок утворюється у напрямку найбільшого ступеня перекривання електронних хмар взаємодіючих атомів. Саме у цьому випадку виділяється найбільша кількість енергії і зв’язок є найміцнішим.
Способи перекривання електронних хмар.
Якщо ділянка перекривання електронних хмар знаходиться на осі, що з’єднує ядра взаємодіючих атомів, такий спосіб перекривання електронних хмар називається -зв’язком. Саме таким способом відбувається перекривання s-електронних хмар двох взаємодіючих атомів, s-електронної хмари одного атома та р-електронної хмари іншого атома, р-електронних хмар обох атомів:
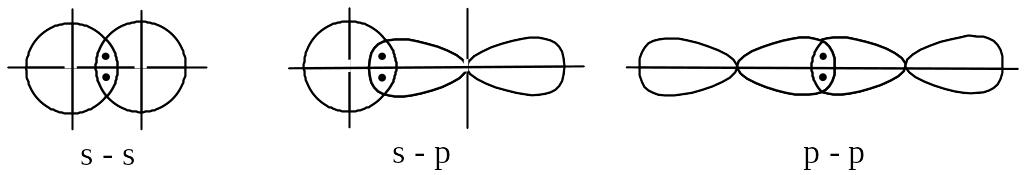
Але перекривання р-електронних хмар двох атомів може відбуватись іншим способом, який називається -зв’язком. В цьому випадку ділянки перекривання р-електронних хмар знаходяться по обидва боки від осі, що з’єднує ядра взаємодіючих атомів.
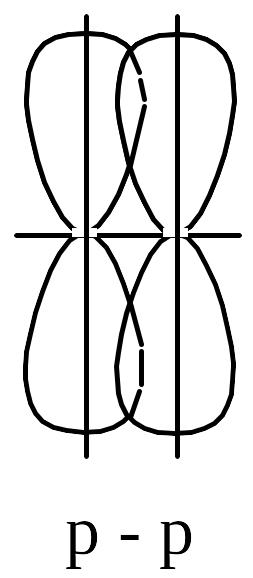
-Зв’язок є слабшим, ніж -зв’язок за участю р-електроних хмар, тому що в цьому випадку ніщо не заважає відштовхуватись ядрам атомів один від одного, що призводить до меншого ступеня перекривання р-електронних хмар.
Слід пам’ятати, що - та -зв’язки – це не типи хімічного зв’язку, а способи перекривання електронних хмар.
Гібридизація ао
Валентні s- та р-АО поділяють на зв’язуючі та незв’язуючі АО. До зв’язуючих АО належать АО, що містять неспарені електрони (s, px, pу, pz) і здатні утворювати спільну електронну пару з неспареними електронами інших атомів. Атомні орбіталі, заповнені електронними парами (s2, px2, pу2, pz2), не беруть участь в утворенні хімічного зв’язку з неспареними електронами інших атомів. Тому такі АО називаються незв`язуючими.
Гібридизація АО полягає в тому, що при змішуванні валентних АО різних підрівнів утворюється стільки ж, але рівноцінних АО, які називаються гібридними.
Основні положення теорії гібридизації:
Гібридні АО однакові за енергією та формою електронних хмар:

– В гібридизації беруть участь АО лише центрального атома, а АО оточуючих атомів залишаються негібридними. На наведених нижче прикладах підкреслені центральні атоми:
BeF2, BCl3, CH4, H2O, NH3.
– Вихідними АО у більшості є зв’язуючі АО різних підрівнів. В цьому випадку центральний атом перебуває у збудженому стані. Отже, якщо неспарені електрони розміщені на АО різних підрівнів, то саме ці АО при змішуванні утворюють гібридні АО. Число утворених гібридних АО та тип гібридизації визначається числом та видом зв'язуючих АО.
– Якщо неспарені електрони містяться на АО одного і того ж підрівня, то гібридизація таких АО не відбувається.
Винятком є атоми оксигену та нітрогену, в яких при утворенні хімічного зв’язку з атомами інших елементів в гібридизації беруть участь не тільки зв’язуючі АО, а і незв’язуючі АО, тобто АО і з неспареними електронами, і з електронними парами.
– Гібридизація АО вимагає витрати енергії. Але при утворенні звzзку ступінь перекривання гібридних електронних хмар з електронними хмарами оточуючих атомів більший, ніж ступінь перекривання негібридних електронних хмар. Це призводить до виділення більшої кількості енергії і до утворення більш міцного зв’язку.
