- •2. Будова атомів
- •Зв'язок між положенням хімічного елемента у періодичній системі та електронною будовою його атомів
- •3. Хімічний зв‘язок
- •Типи хімічного зв’язку
- •Ковалентний зв’язок
- •Гібридизація ао
- •Типи гібридизації
- •Типи молекул
- •Молекули з кратними зв’язками
- •Йонний зв’язок
- •Міжмолекулярна взаємодія. Водневий зв'язок
- •Тверді речовини. Кристалічний стан речовин
- •4. Класи неорганічних сполук
- •Хімічні властивості оксидів.
- •Розділ іі. Закономірності перебігу хімічних реакцій
- •5. Хімічна термодинаміка
- •6. Хімічна кінетика та рівновага Хімічна кінетика
- •Хімічна рівновага
- •7. Природа розчинів та способи вираження їх складу
- •8. Властивості розчинів неелектролітів
- •Отже, обидва розчини киплять за однакової температури (100,52 0с) та замерзають за однакової температури (-1,86 0с).
- •9. Розчини електролітів
- •Кількісні характеристики процесу дисоціації
- •Класифікація електролітів за характером утворених йонів
- •Дисоціація води
- •Реакції обміну в розчинах електролітів
- •І. Гідроліз солі, утвореної сильною основою і слабкою кислотою
- •Іі. Гідроліз солі, утвореної слабкою основою та сильною кислотою
- •Висновки:
- •Кількісні характеристики процесу гідролізу солей
- •Класифікація окисно-відновних реакцій
- •10. ГальванічНі елементи
- •Типи електродів
- •Концентраційні гальванічні елементи
- •11. Напрямок перебігу окисно-відновних реакцій
- •12. Корозія металів та сплавів
- •13. Електроліз
- •Катодні процеси.
- •Анодні процеси
- •Додаток
- •5. Григор`єва в.В., Самійленко в.М., Сич а.М. Загальна хімія: Підручник – к.: Вища шк., 1991. – 431 с., isbn 5-11-003667-5.
10. ГальванічНі елементи
Електрохімія вивчає взаємні перетворення хімічної та електричної енергії. Відповідно до визначення електрохімічні процеси поділяють на дві основні групи: 1) процеси перетворення хімічної енергії на електричну (процеси у гальванічних елементах), 2) процеси перетворення електричної енергії на хімічну (електроліз).
В електрохімії використовують поняття “електрод”. Електрод – це електронний провідник, що знаходиться в контакті з йонним провідником, тобто з розчином або розплавом електроліту.
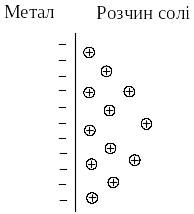
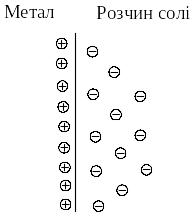
Розглянемо у якості електрода металічну пластину, занурену у водний розчин солі цього металу. Кристалічна решітка металу складається з атомів та катіонів металу, між якими вільно рухаються валентні електрони. У розчині солі катіони металу оточені полярними молекулами води, тобто перебувають у вигляді гідратів.
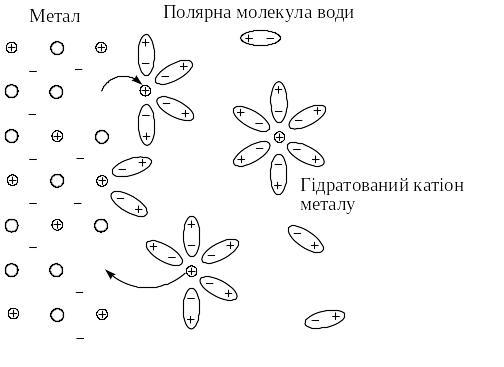
В залежності від хімічної природи металів на поверхні металу можливі такі процеси:
В першому випадку, як наприклад, на поверхні пластини цинку, зануреної у розчин солі ZnSO4, катіони металу, що розташовані у вузлах кристалічної решітки, під дією полярних молекул води здатні переходити з поверхні металу у розчин, залишаючи на поверхні електрони, заряд яких не компенсується катіонами металу. Поверхня металу набуває негативного заряду, а біля поверхні у розчині внаслідок електростатичного притягання зосереджуються катіони металу.
У другому випадку, як, наприклад, на поверхні мідної пластини, зануреної у розчин солі CuSO4, катіони металу, що знаходяться у розчині, під дією притягання електронів на поверхні металу здатні, залишаючи свою гідратну оболонку, переходити у склад кристалічної решітки. В цьому випадку поверхня металу набуває позитивного заряду, а біля поверхні у розчині зосереджуються аніони кислотного залишку: у розглянутому прикладі – це йони SO42-.
По мірі зростання заряду поверхні металу та збільшення концентрації йонів протилежного знаку у розчині біля поверхні, стає можливим перехід катіонів металу у зворотному напрямку: в першому випадку – з розчину до металу, а в другому – з металу у розчин. З часом швидкість переходу катіонів металу в обох напрямках стає однаковою, тобто встановлюється рівновага.
Але в першу мить контакту електрода з електролітом перехід катіонів металу відбувається переважно в одному напрямку. Це призводить до утворення подвійного електричного шару: один шар – це поверхня металу, а інший – шар йонів біля поверхні. Між цими двома шарами, тобто між поверхнею електрода та електролітом, виникає різниця потенціалів, яка називається електродним потенціалом і позначається “φ”.
Подвійний електричний шар на межі поділу:
а) цинковий електрод – розчин солі ZnSO4; |
б) мідний електрод – розчин солі CuSO4. |
|
|
Гальванічний елемент (ГЕ) – це пристрій, в якому енергія хімічної реакції, а саме, окисно-відновної реакції, перетворюється безпосередньо на електричну енергію.
Отже, гальванічний елемент – це хімічне джерело електроенергії.
Гальванічний елемент складається з двох електродів, занурених у розчини певних електролітів і з’єднаних між собою металічним провідником (зовнішнє коло), а розчини електролітів розділяються пористою перегородкою (внутрішнє коло).
Умовне позначення складу гальванічного елемента має назву “схема ГЕ”:
![]()
(Анод) електрод | електроліт || електроліт | електрод (Катод)
“–” I I II II “+”
В схемі ГЕ одна вертикальна риса – це межа поділу між електродом та електролітом, а дві вертикальні риси – межа поділу між електролітами.
Внаслідок різної величини електродних потенціалів на одному з електродів відбувається окиснення (віддавання електронів певною речовиною). Цей електрод називається анодом, а окиснення на його поверхні – анодним процесом. Електрони по металічному провіднику, який з’єднує електроди, рухаються від анода до іншого електрода, на поверхні якого відбувається відновлення (приєднання електронів певними частинками електроліту). Цей електрод називається катодом, а відновлення на його поверхні – катодним процесом.
Анодні та катодні процеси мають загальну назву – електродні процеси.
Сумарна окисно-відновна реакція, рівняння якої одержують, складаючи ліві частини анодного та катодного процесів та їх праві частини, називається струмоутворюючою реакцією.
Анод є негативним електродом ГЕ, оскільки він постачає електрони у зовнішнє коло, а катод – позитивним електродом. Електродний потенціал анода менший за електродний потенціал катода:
φ анода < φ катода
Напрямлений потік електронів, які рухаються від анода до катода у зовнішньому колі, і є електричний струм.
Замикає електричне коло ГЕ рух йонів у розчині (внутрішнє коло).
Умовою роботи ГЕ є просторове розділення процесу окиснення та процесу відновлення, яке здійснюється завдяки наявності пористої перегородки між розчинами електролітів. У випадку її відсутності учасники анодного процесу передають електрони не у зовнішнє коло, а безпосередньо учасникам катодного процесу у розчині, внаслідок чого хімічна енергія перетворюється на теплову, а не на електричну.
Кількісною характеристикою роботи ГЕ є його електрорушійна сила Е.
Електрорушійна сила гальванічного елемента – це різниця між рівноважними електродними потенціалами.
Під час руху електронів у зовнішньому колі виконується максимальна корисна електрична робота Ак:
Ак= nFE (10.1)
де
n
– кількість
електронів, що беруть участь у
струмоутворюючій реакції, моль; F
– стала
Фарадея (F=96,5
![]() );
E
– електрорушійна
сила ГЕ, В.
);
E
– електрорушійна
сила ГЕ, В.
В свою чергу корисна робота здійснюється за рахунок зменшення енергії Гіббса струмоутворюючої реакції:
Ак= – ΔG (10.2)
З виразів (10.1) та (10.2) випливає:
ΔG = – nFE (10.3)
Аналізуючи цей вираз, можна зробити висновок, що ΔG < 0, якщо Е > 0, тобто, якщо електрорушійна сила гальванічного елемента – величина додатна.
Тому для розрахунку електрорушійної сили ГЕ потрібно від електродного потенціалу катода віднімати електродний потенціал анода:
Е = φ катода – φ анода > 0 (10.4)
У схемі окремого електрода зліва від вертикальної риси вказують речовини у розчині, які беруть участь в електродному процесі, а справа – матеріал електрода. Поряд записують рівняння рівноважного електродного процесу:
склад розчину | матеріал електрода , Ox + n·e– Red,
де Ox – окиснена форма учасника електродного процесу, Red – її відновлена форма.
Електродний потенціал, який виникає на межі поділу між електродом та електролітом, залежить:
від природи електрода та електроліту,
від температури Т,
від парціального тиску тої газуватої речовини, яка бере участь в електродному процесі, р,
від концентрації учасників електродного процесу у розчині.
За стандартних умов, тобто, якщо:
Т=298 К,
парціальний тиск газуватої речовини р=101,3 кПа (умовна одиниця),
концентрація учасників електродного процесу у розчині 1 моль/л,
електродний потенціал називається стандартним і позначається φ0.
За умов, що відрізняються від стандартних, електродні потенціали
розраховують за рівнянням Нернста:
![]() (10.5)
(10.5)
де n – кількість електронів в електродному процесі;
[Ox] та [Red] – концентрації окисненої та відновленої форм учасника електродного процесу.