
- •2. Будова атомів
- •Зв'язок між положенням хімічного елемента у періодичній системі та електронною будовою його атомів
- •3. Хімічний зв‘язок
- •Типи хімічного зв’язку
- •Ковалентний зв’язок
- •Гібридизація ао
- •Типи гібридизації
- •Типи молекул
- •Молекули з кратними зв’язками
- •Йонний зв’язок
- •Міжмолекулярна взаємодія. Водневий зв'язок
- •Тверді речовини. Кристалічний стан речовин
- •4. Класи неорганічних сполук
- •Хімічні властивості оксидів.
- •Розділ іі. Закономірності перебігу хімічних реакцій
- •5. Хімічна термодинаміка
- •6. Хімічна кінетика та рівновага Хімічна кінетика
- •Хімічна рівновага
- •7. Природа розчинів та способи вираження їх складу
- •8. Властивості розчинів неелектролітів
- •Отже, обидва розчини киплять за однакової температури (100,52 0с) та замерзають за однакової температури (-1,86 0с).
- •9. Розчини електролітів
- •Кількісні характеристики процесу дисоціації
- •Класифікація електролітів за характером утворених йонів
- •Дисоціація води
- •Реакції обміну в розчинах електролітів
- •І. Гідроліз солі, утвореної сильною основою і слабкою кислотою
- •Іі. Гідроліз солі, утвореної слабкою основою та сильною кислотою
- •Висновки:
- •Кількісні характеристики процесу гідролізу солей
- •Класифікація окисно-відновних реакцій
- •10. ГальванічНі елементи
- •Типи електродів
- •Концентраційні гальванічні елементи
- •11. Напрямок перебігу окисно-відновних реакцій
- •12. Корозія металів та сплавів
- •13. Електроліз
- •Катодні процеси.
- •Анодні процеси
- •Додаток
- •5. Григор`єва в.В., Самійленко в.М., Сич а.М. Загальна хімія: Підручник – к.: Вища шк., 1991. – 431 с., isbn 5-11-003667-5.
Класифікація окисно-відновних реакцій
Реакції міжмолекулярного окиснення-відновлення – це реакції, в яких окисником та відновником є атоми елементів, що знаходяться у складі різних речовин.
У наведеному нижче, як приклад, рівнянні реакції розставляємо ступені окиснення всіх атомів і підкреслимо атоми тих елементів, які під час перебігу реакції змінили свій ступінь окиснення:
![]()
Отже, змінюється ступінь окиснення атомів брому та хлору.
Складаємо електронні схеми процесів окиснення та відновлення:

За правилом електронного балансу перед молекулою Cl2 ставимо коефіцієнт 3, а потім розставляємо коефіцієнти перед іншими речовинами так, щоб число атомів калію, хлору, гідрогену та оксигену було однаковим і в лівій, і в правій частинах рівняння:
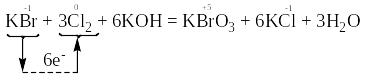
Атом-відновник, тобто атом брому зі ступенем окиснення “-1”, віддає електрони, тобто окиснюється і продуктом його окиснення є атом брому зі ступенем окиснення “+5” в молекулі KBrO3. Речовина KBr, у складі якої міститься атом Br-1, є відновником.
Атоми-окисники, тобто атоми хлору зі ступенем окиснення “0”, приєднують електрони і відновлюються з утворенням продуктів відновлення, якими є атоми хлору зі ступенем окиснення “-1” в молекулах KCl. Проста речовина хлор, у складі якої містяться атоми Cl0 є окисником.
Отже, в цьому прикладі атом-відновник і атоми-окисники знаходяться у складі молекул різних речовин.
Перехід електронів від атома-відновника до атомів-окисників позначений стрілкою.
Реакції внутрішньомолекулярного окиснення-відновлення – це реакції, в яких окисником та відновником є атоми різних елементів або атоми одного і того ж елемента, але з різним ступенем окиснення, які знаходяться в молекулах однієї і тієї ж речовини.
Прикладом є реакція термічного розкладу калій хлорату за рівнянням:
![]()
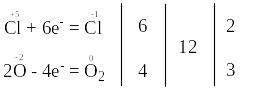
В цій реакції змінюють свій ступінь окиснення атоми хлору та оксигену, які містяться в молекулі KClO3.
Запишемо електронні схеми процесів окиснення та відновлення:
За правилом електронного балансу розставляємо коефіцієнти: перед молекулами KCl та O2 – відповідно 2 та 3, і коефіцієнт 2 перед молекулою KClO3 для того, щоб число атомів калію, хлору та оксигену було однаковим в обох частинах рівняння:
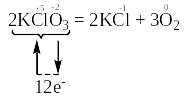
Окисниками є атоми хлору зі ступенем окиснення “+5” в молекулах KClO3. Вони приєднують електрони, тобто відновлюються. Продуктами їх відновлення є атоми хлору зі ступенем окиснення “-1” в молекулах KCl.
Відновниками є атоми оксигену зі ступенем окиснення “-2” в молекулах KClO3. Вони віддають електрони, тобто окиснюються. Продуктами їх окиснення є атоми оксигену зі ступенем окиснення “0” в молекулах кисню.
Отже, окисники (атоми Cl+5) та відновники (атоми О–2) знаходяться у складі молекул однієї і тієї ж речовини KClO3.
Перехід електронів від атомів-відновників до атомів-окисників позначений у рівнянні реакції стрілкою.
В реакції за рівнянням:
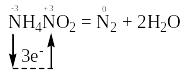
відбувається перехід електронів від одного атома нітрогену зі ступенем окиснення “-3” до іншого атома нітрогену зі ступенем окиснення “+3”, які знаходяться в молекулі NH4NO2:

Відновником є атом нітрогену зі ступенем окиснення “-3”, він віддає електрони і продуктом його окиснення є атом нітрогену зі ступенем окиснення “0”. Окисником є атом нітрогену зі ступенем окиснення “+3”, він приєднує електрони і продуктом його відновлення є також атом нітрогену зі ступенем окиснення “0”.
Оскільки окисником (атом N+3) та відновником (атом N-3) є атоми одного і того ж елемента, але з різним ступенем окиснення, що знаходяться в молекулі однієї і тієї ж речовини NH4NO2, то ця реакція належить до реакцій внутрішньомолекулярного окиснення-відновлення.
Реакції самоокиснення-самовідновлення – це реакції, в яких окисником та відновником є атоми одного і того ж елемента з однаковим проміжним ступенем окиснення, які знаходяться у складі молекул однієї і тієї ж речовини.
Прикладом є реакція, яка відбувається за таким рівнянням:
![]()
В цій реакції змінюють свій ступінь окиснення тільки атоми фосфору, що містяться в молекулах H3PO3.
Запишемо електронні схеми процесів окиснення та відновлення:
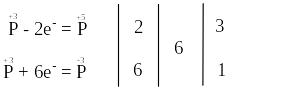
За правилом електронного балансу перед молекулою H3PO4 ставимо коефіцієнт 3. Для того, щоб число атомів фосфору, гідрогену та оксигену було однаковим і в лівій, і в правій частинах рівняння, перед молекулою H3PO3 ставимо коефіцієнт 4:
![]()
В цій реакції і окисником, і відновником є атоми одного і того ж елемента з однаковим проміжним ступенем окиснення (атоми Р+3), що знаходяться в молекулах однієї і тієї ж речовини H3PO3. Отже, речовина H3PO3 виявляє властивості як окисника, так і відновника.
Перехід електронів від атомів-відновників до атома-окисника позначений стрілкою:

Продуктом окиснення відновників (атомів Р+3) є атоми фосфору зі ступенем окиснення “+5” в молекулах H3PO4, а продуктом відновлення окисника (атома Р+3) є атом фосфору зі ступенем окиснення “-3” в молекулі PH3.
Приклад 4. Розставте ступені окиснення елементів в наведених рівняннях окисно-відновних реакцій. Вкажіть тип окисно-відновних реакцій. За правилом електронного балансу доберіть коефіцієнти в рівняннях реакцій:
а) KMnO4 + H2S + H2SO4 → MnSO4 + S + K2SO4 + H2O
б) Pb(NO3)2 → PbO + NO2 + O2
в) H2O2 → H2O + O2
Розв’язання.
Розставляємо ступені окиснення атомів елементів в рівняннях реакцій і підкреслимо атоми, ступені окиснення яких змінились внаслідок перебігу реакцій.
а) В цій реакції змінюють свій ступінь окиснення атом мангану в молекулі KMnO4 та атом сульфуру в молекулі H2S.
![]()
Електронні схеми процесів окиснення та відновлення:

Користуючись правилом електронного балансу, ставимо перед молекулою KMnO4 коефіцієнт 2, а перед молекулою H2S – коефіцієнт 5, і переносимо ці коефіцієнти у праву частину рівняння, тобто ставимо перед речовинами MnSO4 та S відповідно 2 та 5. Перед іншими речовинами ставимо такі коефіцієнти, щоб число кислотних залишків SO42– та атомів гідрогену було однаковим в обох частинах рівняння: перед молекулою Н2SO4 ставимо коефіцієнт 3, а перед молекулою Н2О – 8.
Остаточне рівняння реакції має такий вигляд:
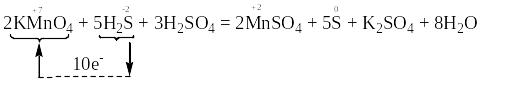
Атом-відновник, тобто атом сульфуру зі ступенем окиснення “-2” окиснюється, підвищуючи свій ступінь окиснення. Отже, речовина H2S є відновником. Продуктом окиснення відновника є проста речовина сірка, в якій ступінь окиснення атомів сульфуру дорівнює “0”.
Атом-окисник, тобто атом мангану зі ступенем окиснення “+7” відновлюється, понижуючи свій ступінь окиснення. Отже, речовина KMnO4 є окисником. Продуктом відновлення окисника є сіль MnSO4, в якій міститься атом мангану зі ступенем окиснення “+2”.
Перехід електронів від атомів-відновників до атомів-окисників в рівнянні реакції позначений стрілкою.
Оскільки атоми-окисники та атоми-відновники знаходяться у складі молекул різних речовин, то ця реакція належить до реакцій міжмолекулярного окиснення-відновлення.
б) В цій реакції змінюють свій ступінь окиснення атоми нітрогену та оксигену, які знаходяться в молекулі Pb(NО3)2.
![]()
Електронні схеми процесів окиснення та відновлення:
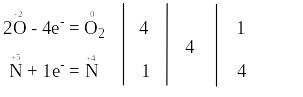
За правилом електронного балансу ставимо перед молекулою NO2 коефіцієнт 4. Для того, щоб число одних і тих же атомів було однаковим і в лівій, і правій частинах рівняння, поставимо коефіцієнт 2 перед молекулою Pb(NО3)2.
Остаточне рівняння реакції:
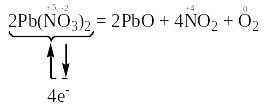
Відновниками є тільки два атоми оксигену зі ступенем окиснення “-2” з 12 атомів, що містяться в двох молекулах Pb(NО3)2, а окисниками – атоми нітрогену зі ступенем окиснення “+5”, що знаходяться також в молекулах Pb(NО3)2. Отже, окисниками та відновниками є атоми різних елементів, що містяться в молекулах однієї і тієї ж речовини. Тому ця реакція належить до реакцій внутрішньомолекулярного окиснення-відновлення.
Продуктами окиснення відновників (атомів О–2) є атоми оксигену зі ступенем окиснення “0” в молекулі O2, а продуктами відновлення окисників (атомів N+5) є атоми нітрогену зі ступенем окиснення “+4” в молекулах NО2.
Перехід електронів від атомів-відновників до атомів-окисників позначений стрілкою.
в) В цій реакції змінюють свій ступінь окиснення тільки атоми оксигену, що входять до складу молекули Н2О2.
![]()
Запишемо електронні схеми процесів окиснення та відновлення:
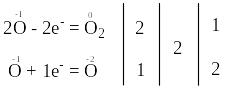
За правилом електронного балансу ставимо перед молекулою Н2О коефіцієнт 2. Для того, щоб число атомів оксигену та гідрогену було одноковим в обох частинах рівняння, поставимо перед молекулою Н2О2 коефіцієнт 2.
Остаточне рівняння реакції має такий вигляд:
![]()
В цій реакції атоми одного і того ж елемента з проміжним ступенем окиснення (атоми О–1), що знаходяться в молекулах однієї і тієї ж речовини Н2О2, і віддають, і приєднують електрони, тобто виявляють властивості і відновників, і окисників. Отже, речовина Н2О2 є і відновником, і окисником. Тому ця реакція належить до реакцій самоокиснення-самовідновлення. Перехід електронів від атомів-відновників до атомів-окисників позначений стрілкою:
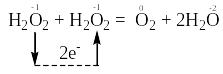
Продуктами окиснення атомів-відновників (О-1) є атоми оксигену зі ступенем окиснення “0” в молекулі кисню. А продуктами відновлення атомів-окисників (О-1) є атоми оксигену зі ступенем окиснення “-2” в молекулах води.
РОЗДІЛ V. ЕЛЕКТРОХІМІЧНІ ПРОЦЕСИ
