
- •2. Будова атомів
- •Зв'язок між положенням хімічного елемента у періодичній системі та електронною будовою його атомів
- •3. Хімічний зв‘язок
- •Типи хімічного зв’язку
- •Ковалентний зв’язок
- •Гібридизація ао
- •Типи гібридизації
- •Типи молекул
- •Молекули з кратними зв’язками
- •Йонний зв’язок
- •Міжмолекулярна взаємодія. Водневий зв'язок
- •Тверді речовини. Кристалічний стан речовин
- •4. Класи неорганічних сполук
- •Хімічні властивості оксидів.
- •Розділ іі. Закономірності перебігу хімічних реакцій
- •5. Хімічна термодинаміка
- •6. Хімічна кінетика та рівновага Хімічна кінетика
- •Хімічна рівновага
- •7. Природа розчинів та способи вираження їх складу
- •8. Властивості розчинів неелектролітів
- •Отже, обидва розчини киплять за однакової температури (100,52 0с) та замерзають за однакової температури (-1,86 0с).
- •9. Розчини електролітів
- •Кількісні характеристики процесу дисоціації
- •Класифікація електролітів за характером утворених йонів
- •Дисоціація води
- •Реакції обміну в розчинах електролітів
- •І. Гідроліз солі, утвореної сильною основою і слабкою кислотою
- •Іі. Гідроліз солі, утвореної слабкою основою та сильною кислотою
- •Висновки:
- •Кількісні характеристики процесу гідролізу солей
- •Класифікація окисно-відновних реакцій
- •10. ГальванічНі елементи
- •Типи електродів
- •Концентраційні гальванічні елементи
- •11. Напрямок перебігу окисно-відновних реакцій
- •12. Корозія металів та сплавів
- •13. Електроліз
- •Катодні процеси.
- •Анодні процеси
- •Додаток
- •5. Григор`єва в.В., Самійленко в.М., Сич а.М. Загальна хімія: Підручник – к.: Вища шк., 1991. – 431 с., isbn 5-11-003667-5.
Висновки:
Для складання рівнянь гідролізу солей потрібно:
1) написати процес дисоціації солі на йони;
2) вказати, якою основою та якою кислотою утворена сіль;
3) визначити, до яких електролітів: сильних чи слабких – належать ці основа та кислота;
4) скласти йонно-молекулярне рівняння реакції взаємодії з водою тільки тих йонів солі, що є залишками слабких (малодисоційованих) електролітів, з яких утворена ця сіль;
5) якщо ці йони є багатозарядними, то гідроліз солі відбувається ступінчасто, і тому рівняння гідролізу складають окремо для кожного ступеня;
6) вказати реакцію розчину солі (рН);
6) скласти молекулярне рівняння гідролізу солі.
Кількісні характеристики процесу гідролізу солей
Кількісно гідроліз солі оцінюють за ступенем гідролізу і константою гідролізу.
Ступінь гідролізу солі показує, яка частка розчиненої солі піддається гідролізу:
![]() (9.19)
(9.19)
Ступінь гідролізу солей у більшості незначний, тому що один з учасників реакції гідролізу – вода є найбільш слабким електролітом і рівновага реакції значною мірою зміщена у напрямку вихідних речовин.
Нижче наведені рівняння реакцій гідролізу таких солей:
а) калій ціаніду KCN, утвореного сильною основою КОН і слабкою кислотою НСN;
б) амоній нітрату NH4NO3, утвореного слабкою основою NH4OH і сильною кислотою НNO3:
а) СN– + H2O HCN + OH– , (9.20)
б) NH4+ + H2O NH4OH + H+ (9.21)
Як випливає з цих рівнянь, концентрація йонів ОН- (9.20) та йонів Н+ (9.21), які знаходяться у розчинах солей в надлишку, дорівнює концентрації гідролізованої солі.
Тому ступінь гідролізу солей дорівнює:
а)
![]() (9.22)
(9.22)
б)
![]() (9.23)
(9.23)
Ступінь гідролізу солі залежить від температури та концентрації солі у розчині.
Гідроліз солі можна розглядати як процес, обернений реакції нейтралізації, тобто реакції взаємодії кислоти з основою. Оскільки реакція нейтралізації є екзотермічною, то гідроліз солі – ендотермічна реакція. За принципом Ле Шательє підвищення температури зміщує рівновагу у напрямку ендотермічної реакції, якою є гідроліз солі. Тому за нагрівання розчину солі ступінь її гідролізу збільшується.
За розбавляння розчину зменшується концентрація солі у розчині і збільшується кількість молекул води, що припадають на один йон солі. За принципом Ле Шательє рівновага реакції зміщується у напрямку зменшення кількості води, тобто у напрямку перебігу реакції гідролізу солі. Тому за розбавляння розчину солі ступінь її гідролізу збільшується.
Отже, і нагрівання, і розбавляння розчинів сприяють перебігу реакції гідролізу солей. Тому для послаблення гідролізу солей, тобто для зменшення ступеня їх гідролізу, потрібно зберігати розчини з високою концентрацією солі та за низьких температур.
Крім того, зміщенню рівноваги процесів (9.20) та (9.21) у зворотному напрямку сприяє збільшення концентрації йонів ОН– в реакції (9.20), тобто додавання розчину лугу до розчину солі KCN, а в реакції (9.21) – збільшення концентрації йонів Н+, тобто додавання розчину кислоти до розчину солі NH4NO3. Таким чином, до зменшення ступеня гідролізу солі призводить додавання до розчину солі одного з продуктів гідролізу – кислоти або лугу.
Оскільки гідроліз солі є оборотним процесом, то його можна охарактеризувати константою рівноваги, яка називається у цьому випадку константою гідролізу солі Кг.
В розбавлених розчинах концентрація води є практично сталою величиною, тому вираз константи гідролізу солей (9.20) та (9.21) має такий вигляд:
а)
![]() , (9.24)
, (9.24)
б)
 (9.25)
(9.25)
Помноживши чисельник і знаменник виразу (9.24) на концентрацію йонів Н+, а виразу (9.25) на концентрацію йонів ОН–, отримаємо:
а)
![]() (9.26)
(9.26)
б)
 (9.27)
(9.27)
де [H+][ОН–] – це йонний добуток води Кв,
а
![]() -
константа дисоціації слабкої кислоти
К(HCN),
-
константа дисоціації слабкої кислоти
К(HCN),
 -
константа дисоціації слабкої основи
К(NH4OH).
-
константа дисоціації слабкої основи
К(NH4OH).
За аналогією можна показати, що константа гідролізу солі, утвореної слабкою основою і слабкою кислотою, дорівнює:
![]() (9.28)
(9.28)
Ступінь гідролізу та константа гідролізу солей зв’язані між собою виразом, який має вигляд, подібний виразу (9.5):
![]() (9.29)
(9.29)
Якщо 1, то вираз (9.29) спрощується:
![]() (9.30)
(9.30)
З виразів (9.26), (9.27) і (9.28) можна зробити висновок, що, чим менша константа дисоціації слабких електролітів, утворених внаслідок гідролізу солей, тобто, чим слабкішими є ці електроліти, тим більшою є константа гідролізу солі, а згідно з виразом (9.30) – більшим є і ступінь гідролізу солі, тобто повніше гідролізуватиме сіль.
Приклад 11. Константа гідролізу натрієвої солі слабкої одноосновної кислоти НА дорівнює 2,510-8. Розрахуйте:
а) ступінь гідролізу солі у розчині з концентрацією солі с(NaA) = 0,004 моль/л;
б) рОН та рН розчину солі;
в) константу дисоціації кислоти НА.
Розв'язання.
Оскільки сіль утворена сильною основою NaОН та слабкою кислотою НА, у гідролізі солі беруть участь тільки йони А– (NaА = Na+ + А–):
А– + Н2О НА + ОН– (9.31)
а) Знаходимо ступінь гідролізу солі за виразом (9.30):
![]()
б) За виразом (9.22) розрахуємо концентрацію йонів ОН–, які утворюються у розчині внаслідок гідролізу солі за рівнянням (9.31):
[OH–] = с(NaA) = 2,510–3 410–3 моль/л = 10–5 моль/л.
Згідно з виразами (9.11) та (9.12):
pOH = –lg[OH–] = –lg10–5 = 5,
pH = 14 – pOH = 9
в) Обчислимо константу дисоціації кислоти НА (9.26):
![]()
Приклад 12. Розрахуйте а) константу гідролізу солі, утвореної слабкою основою ХОН та нітратною кислотою; б) ступінь її гідролізу у розчині з концентрацією солі с(ХNO3)=0,5 моль/л; в) рН розчину солі. Константа дисоціації основи ХОН дорівнює: К(ХОН)=510-7.
Розв'язання.
Оскільки нітратна кислота HNO3 є сильним електролітом, у гідролізі солі беруть участь тільки йони слабкої основи Х+ (ХNO3 = Х+ + NO3–):
Х+ + Н2О ХОН + Н+ (9.32)
а) Розрахуємо константу гідролізу солі (9.27):
![]()
б) Обчислимо ступінь гідролізу солі (9.30):
![]()
в) За виразом (9.23) розрахуємо концентрацію йонів Н+, які утворюються за рівнянням (9.32), та рН розчину (9.10):
[H+] = c(XNO3) = 210–4 0,5 моль/л = 10–4 моль/л
рН = –lg[H+] = –lg10–4 = 4
РОЗДІЛ ІV. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ
Окисно-відновні реакції – це реакції, які супроводжуються зміною ступенів окиснення атомів елементів, що входять до складу реагуючих речовин.
Ступінь окиснення – це умовний заряд атома у сполуці, який виник би у разі повного зміщення спільних електронних пар до атомів більш електронегативних елементів.
Правила визначення ступенів окиснення атомів:
В простих речовинах ступінь окиснення атомів дорівнює “0”:
![]()
В сполуках ступінь окиснення атомів більш електронегативних елементів позначають знаком “–“ , а менш електронегативних елементів – знаком “+”.
Найвищий ступінь окиснення атомів більшості неметалів і металів у сполуках є позитивним і чисельно дорівнює номеру групи періодичної системи, в якій розташований елемент.
Найнижчий ступінь окиснення атомів неметалів в сполуках є негативним і дорівнює “8 – номер групи періодичної системи”.
Ступінь окиснення атомів металів в сполуках завжди позитивний. Отже, їх найнижчий ступінь окиснення дорівнює “0”.
Ступінь окиснення атомів оксигену дорівнює:
– у більшості сполук, а саме, в оксидах, кислотах, основах та солях – “-2”:
![]() ;
;
– в пероксидах – “-1”:
![]() ;
;
в
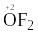 сполуці з флуором – “+2”, оскільки
флуор є найбільш електронегативним
елементом:
сполуці з флуором – “+2”, оскільки
флуор є найбільш електронегативним
елементом:
Ступінь окиснення атомів гідрогену дорівнює:
в сполуках з неметалами – “+1”, тому що гідроген є менш електронегативним елементом, ніж більшість неметалів:
;![]()
в сполуках з металами (гідридах) – “-1”, оскільки гідроген є більш електронегативним елементом, ніж метали:
![]()
Алгебраїчна сума ступенів окиснення всіх атомів в молекулі дорівнює нулю.
Приклад 1. Розрахуйте ступінь окиснення атомів підкреслених елементів в сполуках: K2Cr2O7, HNO3, Al2O3.
Розв’язання.
Поставимо над символами елементів ступінь окиснення їх атомів, користуючись наведеними вище правилами.
Ступінь окиснення атомів гідрогену та оксигену в цих сполуках дорівнює відповідно “+1” та “-2”. Елемент калій знаходиться в групі І періодичної системи і виявляє металічні властивості. Тому ступінь окиснення його атомів в сполуках становить “+1”.
Враховуючи, що алгебраїчна сума ступенів окиснення всіх атомів в молекулі дорівнює нулю, обчислимо ступінь окиснення атомів підкреслених елементів:
![]()
2·(+1)+2·х+7·(-2)=0 +1+х+3·(-2)=0 2·х+3·(-2)=0
х=+6 х=+5 х=+3
–– –– –– –– –– ––
Розглянемо реакцію взаємодії алюмінію з киснем, яка відбувається за рівнянням:
![]()
Реакція належить до окисно-відновних, тому що супроводжується зміною ступенів окиснення атомів алюмінію та оксигену: в простих речовинах їх ступінь окиснення дорівнює “0”, а в оксиді – відповідно “+3” та “-2”.
Отже, атом алюмінію віддає три електрони, набуваючи в оксиді ступеня окиснення “+3”:
![]()
Віддавання атомом електронів називається окисненням, а сам атом та речовина, яка містить такий атом, – відновником.
В цій реакції відновником є проста речовина алюміній. Атоми- відновники, тобто атоми алюмінію, окиснюються і їх ступінь окиснення підвищується від 0 до “+3”.
Відновник є одночасно і відновленою формою (Red) речовини, яка під час перебігу реакції перетворюється у її окиснену форму (Ох).
В реакції, що розглядається, відновленою формою алюмінію є проста речовина алюміній, що перетворюється у його окиснену форму (Ох) – алюміній оксид, в якій атоми алюмінію набувають ступеня окиснення “+3”.
Кожний атом оксигену в молекулі кисню приєднує два електрони, а два атоми приєднують чотири електрони:
![]()
Приєднання атомом електронів називається відновленням, а сам атом та речовина, яка містить такий атом, – окисником.
Окисником в цій реакції є проста речовина кисень. Атоми-окисники, тобто атоми оксигену, відновлюються і їх ступінь окиснення понижується від “0” до “-2”.
Окисник є окисненою формою (Ох) речовини, яка під час перебігу реакції перетворюється у її відновлену форму (Red).
В цій реакції окиснена форма оксигену, тобто кисень, перетворюється у відновлену форму – алюміній оксид, в якій атоми оксигену набувають ступеня окиснення “-2”.
Будь-яку окисно-відновну реакцію можна охарактеризувати такою схемою:

Якщо позначити відновлену та окиснену форми однієї речовини – Red (I) та Ox (I), а іншої речовини – Red (II) та Ox (II), то схема окисно-відновної реакції має вигляд:

Треба пам’ятати, що ступінь окиснення атомів елемента в окисненій формі (Ox) більший за ступінь окиснення – у його відновленій формі (Red).
Коефіцієнти в рівняннях окисно-відновних реакцій розставляють за правилом електронного балансу: “Число електронів, що віддають всі атоми відновника, має дорівнювати числу електронів, що приєднують всі атоми окисника.”
Процеси окиснення та відновлення в окисно-відновних реакціях, тобто і в реакції, яка розглядається як приклад, зображують у вигляді електронних схем:

За правилом електронного балансу знаходимо коефіцієнти біля відновника та окисника: перед атомом алюмінію в простій речовині коефіцієнт дорівнює 4, а перед молекулою кисню – 3.
Отже, чотири атоми Al віддають 12 електронів, а три молекули O2 приєднують ці 12 електронів.
Крім того, число атомів одного і того ж елемента у вихідних речовинах і в продуктах реакції має бути однаковим. Тому із зіставлення числа атомів алюмінію та оксигену у лівій і правій частинах рівняння знаходимо, що утворюється 2 молекули алюміній оксиду.
Остаточне рівняння реакції:
![]()
Правила, які дозволяють визначити, які речовини виявляють властивості тільки окисників, тільки відновників або як окисників, так і відновників:
1. Атоми елементів з найвищим ступенем окиснення здатні лише понижувати свій ступінь окиснення, тобто тільки приєднувати електрони. Такі атоми та речовини, у складі яких вони містяться, виявляють властивості тільки окисників.
2. Атоми елементів з найнижчим ступенем окиснення здатні лише підвищувати свій ступінь окиснення, тобто тільки віддавати електрони. Такі атоми та речовини, у складі яких вони містяться, виявляють властивості тільки відновників.
3. Атоми елементів з проміжним ступенем окиснення здатні і приєднувати, і віддавати електрони. Такі атоми та речовини, у складі яких вони містяться, можуть виявляти властивості як окисників, так і відновників.
Приклад 2. Виходячи зі ступеня окиснення атомів елементів, що підкреслені, та їх розташування в періодичній системі, визначте, які речовини виявлятимуть властивості тільки окисника, тільки відновника або як і окисника, так і відновника:
а) HIO4, HI, HIO;
б) Pb, PbO2, PbO.
Розв’язання. Розрахуємо ступінь окиснення атомів йоду та плюмбуму в наведених речовинах.
а)
![]()
+1+х+4·(-2)=0 +1+х=0 +1+х–2=0
х=+7 х=-1 х=+1
Елемент йод розташований в групі VII періодичної системи, отже, найвищим ступенем окиснення його атомів є “+7”. Тому атом йоду в молекулі HIO4 може лише понижувати свій ступінь окиснення, тобто тільки приєднувати електрони, наприклад:
![]()
Отже, речовина HIO4 виявлятиме властивості тільки окисника.
Оскільки елемент йод належить до неметалів, то найнижчий ступінь окиснення його атомів є негативним і дорівнює “8 – номер групи періодичної системи”, а саме, “–1”. Тому атом йоду в молекулі HI здатний тільки віддавати електрони, підвищуючи свій ступінь окиснення, наприклад:
![]()
Отже, речовина HI виявлятиме властивості тільки відновника.
В молекулі HIO міститься атом йоду з проміжним ступенем окиснення, тому він здатний і віддавати, і приєднувати електрони, наприклад:
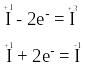
Тому речовина HIO виявлятиме властивості і відновника, і окисника.
б)
![]()
Елемент плюмбум виявляє металічні властивості, тому найнижчий ступінь окиснення його атомів дорівнює “0”. Отже, атоми плюмбуму в простій речовині свинець здатні тільки підвищувати свій ступінь окиснення, тобто тільки віддавати електрони., наприклад:
![]()
Тому проста речовина свинець виявлятиме властивості лише відновника.
Оскільки елемент плюмбум знаходиться в групі IV періодичної системи, то найвищий ступінь окиснення його атомів дорівнює “+4”. Тому атом плюмбуму в оксиді PbО2 здатний лише понижувати свій ступінь окиснення, тобто тільки приєднувати електрони, наприклад:
![]()
Отже, речовина PbО2 виступає тільки як окисник.
Ступінь окиснення атома плюмбуму в оксиді PbО є проміжним, отже, атом плюмбуму зі ступенем окиснення “+2” може і приєднувати, і віддавати електрони, наприклад:
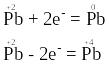
Тому речовина PbО виявлятиме властивості і відновника, і окисника.
Приклад 3. Виходячи зі ступеня окиснення атомів елементів, що підкреслені, та їх розташування в періодичній системі, визначте, чи можливі окисно-відновні реакції між наведеними в умові речовинами:
а) HCl та KNO2;
б) Fe та NH3;
в) H3AsO4 та H2TeO4
Розв’язання. Розрахуємо ступені окиснення атомів підкреслених елементів.
а)
![]()
+1+х+2·(-2)=0, х=+3
Елемент хлор є неметалом і знаходиться в групі VII періодичної системи, тобто найнижчий ступінь окиснення його атомів є негативним і дорівнює “8 – номер групи”, а саме, “–1”. Отже, атом хлору в молекулі HCl може лише підвищувати свій ступінь окиснення, тобто тільки віддавати електрони. Тому речовина HCl є відновником.
Елемент нітроген розташований в групі V періодичної системи і теж належить до неметалів. Найвищий ступінь окиснення його атомів дорівнює “+5”, а найнижчий – “–3”. Отже, атом нітрогену з проміжним ступенем окиснення “+3” в молекулі KNO2 може і віддавати, і приєднувати електрони. Тому речовина KNO2 може бути і окисником, і відновником, але під час взаємодії з речовиною HCl, яка є відновником, виявляє властивості окисника.
Таким чином, між речовинами HCl та KNO2 окисно-відновна реакція можлива.
б)
![]()
Ступінь окиснення атомів феруму в простій речовині залізо, що дорівнює “0”, є для металів найнижчим. Отже, атоми феруму здатні лише підвищувати свій ступінь окиснення, тобто тільки віддавати електрони, Тому проста речовина залізо виявляє властивості тільки відновника.
Ступінь окиснення атома нітрогену “–3” в молекулі NH3 теж є найнижчим, тобто цей атом може тільки віддавати електрони і речовина NH3 є теж тільки відновником.
Тому окисно-відновна реакція між речовинами Fe та NH3 неможлива.
в)
![]()
3·(+1)+х+4·(-2)=0 2·(+1)+х+4·(-2)=0
х=+5 х=+6
Оскільки ступені окиснення атомів арсену та телуру у сполуках чисельно дорівнюють номерам груп періодичної системи, в яких розташовані елементи, то розрахований ступінь окиснення атомів обох елементів є найвищим. Тому ці атоми здатні лише понижувати свої ступені окиснення, тобто тільки приєднувати електрони. Речовини, що містять ці атоми, виявляють властивості тільки окисників. Отже, окисно-відновна реакція між речовинами H3AsO4 та H2ТеO4 неможлива.
