
Лабораторная работа. Коррозия железа в контакте с углеродом в растворе NaCl.
Цель работы:
изучение условий возникновения электрохимической коррозии железа, находящегося в контакте с углеродом, влияние концентрации дополнительного окислителя на скорость коррозии.
1.Теоретическая часть
Коррозия – это необратимое самопроизвольное разрушение металла в результате его физико-химического взаимодействия с окружающей средой.
По механизму протекания различают химическую и электрохимическую коррозию.
Химическая коррозия металла представляет собой гетерогенную окислительно-восстановительную реакцию и наблюдается в средах, не проводящих электрический ток, например, при прямом взаимодействии металла с сухим газом (окислителем) при высокой температуре или в среде агрессивных жидких неэлектролитов.
Электрохимическая коррозия характерна для сред, имеющих ионную проводимость, и представляет собой гетерогенную окислительно-восстановительную реакцию, протекающую по электрохимическому механизму. Электрохимическая коррозия может протекать: 1) в водных растворах солей, кислот, щелочей, в морской воде; 2) в атмосфере влажного газа; 3) в почве.
При электрохимической коррозии на энергетически неоднородной поверхности металла или сплава возникает множество локальных микрогальванических элементов, в которых катодные и анодные участки находятся в непосредственном контакте, то есть накоротко замкнуты. На участках с более отрицательным потенциалом (анодные участки) идет анодное растворение металла, а на участках с более положительным потенциалом (катодные участки) - катодное восстановление окислителя Ох.
На анодных участках : М → Мn+ + nе
На катодных участках : Ox + nе→ Red
Коррозия металла термодинамически возможна при условии, что потенциал окислителя положительнее потенциала металла.
![]() ,
где
,
где
ЕРOx/Red- равновесный потенциал окислителя в данной среде,
ЕРMn+/M - равновесный потенциал металла в данной среде.
Окислителями при электрохимической коррозии чаще всего являются молекулы кислорода воздуха и ионы водорода из среды. При коррозии с участием кислорода, называемой коррозией с поглощением кислорода, или коррозией с кислородной деполяризацией, на катодных участках протекает процесс:
O2
+ 4H+
+ 4![]() → 2H2O
при pH
< 7
→ 2H2O
при pH
< 7
O2 + 2H2O + 4 → 4OH- при pH ³ 7.
Равновесный потенциал окислителя О2 при 298К описывается уравнением:
![]() = 1,227 + 0,0147 lg
= 1,227 + 0,0147 lg![]() –
0,059рН.
–
0,059рН.
При коррозии с участием ионов водорода, называемой коррозией с выделением водорода или коррозией с водородной деполяризацией на катодных участках протекает процесс:
2H+ + 2 → H2 при pH < 7
2H2O + 2 → H2 + 2OH– при pH ³ 7.
Равновесный потенциал системы Н+/Н2 при 298К описывается уравнением:
![]() =
– 0,059рН 0,0295 lg
=
– 0,059рН 0,0295 lg![]()
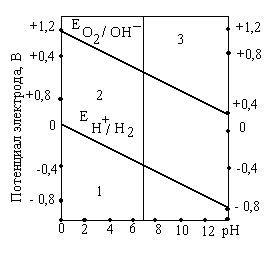
Графически зависимость потенциалов водородного и кислородного электродов от рН приведена на рисунке 1.
 Рисунок
1.
Рисунок
1.
Разные металлы корродируют по-разному, в зависимости от их стандартного потенциала и рН среды:
а)
если потенциал металла положительнее
потенциала кислородного электрода в
данной среде (область 3 рис.1), то коррозия
металла невозможна. Например, золото,
платина не могут корродировать ни с
поглощением О2 , ни с выделением
Н2, так как Еок
<
![]() ;
;
б) если потенциал металла положительнее потенциала водородного электрода и отрицательнее потенциала кислородного электрода в данной среде (область 2), то коррозия возможна с поглощением кислорода и невозможна с выделением водорода, например:
![]() и
и
![]() ;
;
в) если потенциал металла отрицательнее потенциала водородного электрода, то возможна коррозия как с поглощением кислорода, так и с выделением водорода (область 1). Например, щелочные, щелочно-земельные металлы, магний, алюминий, цинк и др.
Сравнение равновесных потенциалов окислителя и восстановителя позволяет установить возможность коррозионного процесса, но не дает информации о его скорости. Скорость коррозии можно характеризовать плотностью коррозионного тока iкор .
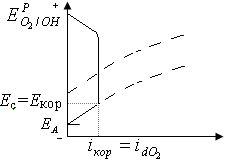
Рисунок 2. Коррозионная диаграмма для коррозии с поглощением кислорода
Если скорость коррозии определяется лимитирующей стадией катодного восстановления кислорода, то она ограничена скоростью диффузии растворенного кислорода к поверхности металла (рис.2)., при этом коррозионный ток iкор равен предельной плотности тока idО2 восстановления кислорода:
id
=
![]() ,
где
,
где
![]()
коэффициент
диффузии кислорода;
коэффициент
диффузии кислорода;
![]() концентрация
кислорода в растворе;
концентрация
кислорода в растворе;
толщина диффузионного слоя. iкор возрастает при перемешивании раствора и увеличении концентрации растворенного кислорода и имеет экстремальную зависимость от температуры.
Если лимитирующей катодной стадией коррозии является выделение водорода (рис.3), то скорость коррозии определяется скоростью восстановления водорода. На рис.3 iкор зависит в равной мере от катодного и анодного процессов и возрастает с увеличением температуры и концентрации ионов водорода. При работе микрогальванических коррозионных элементов потенциал анодного процесса смещается в более положительную сторону, а катодного - в более отрицательную (как в гальваническом элементе). При некотором токе iкор кривые пересекаются. При этом на поверхности металла устанавливается стационарный потенциал Ес, или потенциал коррозии Екор. (Ток анодного растворения металла равен току катодного восстановления окислителя. Омическое падение потенциала практически равно нулю, так как анодные и катодные участки непосредственно контактируют друг с другом.).
На скорость коррозии влияет также природа материала катодных участков. Такие примеси, как платина, кобальт, никель, палладий, катализируют выделение водорода, поэтому скорость катодного процесса на них будет выше, а поляризация меньше, чем на чистом М ( i’ – на рис.3). Другие металлы( например, ртуть, свинец, кадмий), напротив, увеличивают перенапряжение водорода (поляризация катодной кривой увеличится i” – на рис.3).
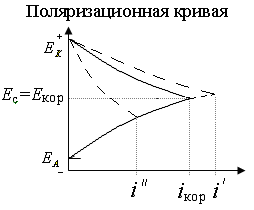
Рисунок 3. Коррозионная диаграмма для коррозии с выделением водорода.
Скорость коррозии может лимитироваться и анодной реакцией, например, при коррозии металлов, способных переходить в пассивное состояние (хром, никель, алюминий, железо и другие) после контакта с окислителем. Пассивность металла – это состояние повышенной коррозионной стойкости, вызванное торможением анодной реакции в результате образования на поверхности металла оксидных, гидроксидных или иных защитных слоёв. Так, например, железо и стали пассивируют в основных средах при рН 9-12 в присутствии растворенного кислорода. Также железо переходит в пассивное состояние в концентрированных кислотах H2SO4 и HNO3.Однако наличие ионов Cl- препятствует образованию пассивных пленок на железе и многих других металлах, ионы Cl- являются активаторами коррозии.
