
- •Тема: механика
- •Кинематика поступательного движения. Скорость и ускорение материальной точки. Составляющие ускорения. Кинематическое уравнение
- •2)Динамика поступательного движения. Сила и масса. Три закона Ньютона
- •Силы в механике: силы тяготения (всемирного тяготения, тяжести, вес тела), сила упругости, сила трения.
- •5)Работа, мощность. Механическая энергия: кинетическая и потенциальная. Закон сохранения энергии.
- •Тема 2. Молекулярная физика и термодинамика
- •Идеальный газ. Уравнение состояния. Законы идеального газа.
- •Средняя кинетическая энергия молекулы идеального газа. Число степеней свободы. Температура.
- •4)Теплоемкость. И . Внутренняя энергия идеального газа. Работа газа.
- •5)Первое начало термодинамики. Применение его к изопроцессам.
- •6)Круговые процессы (циклы). Тепловые и холодильные машины. Кпд. Цикл Карно и его кпд.
- •7) Реальный газ. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса. Внутренняя энергия реальных газов.
- •Тема 3. Электростатика и постоянный электрический ток.
- •Электрический заряд. Закон сохранения электрического заряда. Закон Кулона.
- •Электростатическое поле. Напряженность (для точечного заряда, заряженной плоскости, поля конденсатора). Силовые линии и ее свойства. Принцип суперпозиции.
- •3)Потенциал. Эквипотенциальная поверхность. Связь напряженности и потенциала
- •Электрический ток. Сила тока и плотность тока. Сопротивление проводников и их соединения.
- •1. Соединение проводников
- •Напряжение. Электродвижущая сила. Сторонние силы.
- •Закон Ома для участка цепи и полной цепи. Правила Кирхгофа.
5)Первое начало термодинамики. Применение его к изопроцессам.
Первое начало термодинамики утверждает, что изменение внутренней энергии термодинамической системы (тела) может быть осуществлено двумя путями: путём совершения механической работы и путём теплопередачи.
![]() , где
, где
![]() -
количество теплоты, переданной системе,
-
количество теплоты, переданной системе,
![]() -
изменение внутренней энергии системы
при её переходе из первого состояния
во второе,
-
изменение внутренней энергии системы
при её переходе из первого состояния
во второе,
![]() -
работа, совершённая над системой.
-
работа, совершённая над системой.
Теплота
,
подводимая к системе, идет на изменение
ее внутренней энергии
![]() и
на совершение этой системой работы
и
на совершение этой системой работы
![]() над
внешними телами:
над
внешними телами:![]() .
.
Первое начало термодинамики:
при
изобарном процессе![]()
при
изохорном процессе (A
= 0)![]()
при
изотермическом процессе (ΔU
= 0)![]() Здесь
Здесь
![]() —
масса газа,
—
масса газа,
![]() —
молярная масса газа,
—
молярная масса газа,
![]() —
молярная теплоёмкость при постоянном
объёме,
—
молярная теплоёмкость при постоянном
объёме,
![]() —
давление, объём и температура газа
—
давление, объём и температура газа
6)Круговые процессы (циклы). Тепловые и холодильные машины. Кпд. Цикл Карно и его кпд.
Круговым процессом (или циклом) называется процесс, при котором система, проходя через ряд состояний, возвращается в первоначальное.
Если за цикл совершается положительная работа A=∫pdV>0 (цикл идет по часовой стрелке), то он называется прямым если за цикл осуществляется отрицательная работа A=∫pdV<0 (цикл идет против часовой стрелки), то он называется обратным
Прямой цикл применяется в тепловых двигателях — периодически действующих двигателях, которые совершают работу за счет полученной извне теплоты. Обратный цикл применяется в холодильных машинах — периодически действующих установках, в которых за счет работы внешних сил теплота переходит к телу с более высокой температурой.
![]()
Коэффициент
полезного действия (кпд) цикла Карно —
отношение суммарной работы за цикл к
полученному теплу:
 ,
,
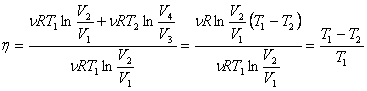 .
.
Цикл Карно́ — идеальный термодинамический цикл. Тепловая машина Карно, работающая по этому циклу, обладает максимальным КПД из всех машин, у которых максимальная и минимальная температуры осуществляемого цикла совпадают соответственно с максимальной и минимальной температурами цикла Карно.
кпд
цикла Карно всегда меньше единицы (100%)
и зависит только от соотношения температур
холодильника и нагревателя:
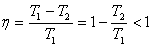 .
.
7) Реальный газ. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса. Внутренняя энергия реальных газов.
Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева. Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём.
Уравнение Ван-дер-Ваальса
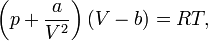 где
p —
давление, V —
молярный объём, T —
абсолютная температура,R —
универсальная газовая постоянная. a
и b
— экспериментальные константы,
учитывающие отклонение свойств реального
газа от свойств идеального газа.
где
p —
давление, V —
молярный объём, T —
абсолютная температура,R —
универсальная газовая постоянная. a
и b
— экспериментальные константы,
учитывающие отклонение свойств реального
газа от свойств идеального газа.
Для исследования поведения реального газа рассмотрим изотермы Ван-дер-Ваальса — кривые зависимости р от Vm при заданных Т, определяемые уравнением Ван-дер-Ваальса (61.2) для моля газа. Эти кривые (рассматриваются для четырех различных температур; рис. 89) имеют довольно своеобразный характер. При высоких температурах (T > Tк) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре Tк на изотерме имеется лишь одна точка перегиба К.
Эта изотерма называется критической, соответствующая ей температура Tк — критической температурой; точка перегиба К называется критической точкой; в этой точке касательная к ней параллельна оси абсцисс. Соответствующие этой точке объем Vк, и давление рк называются также критическими. Состояние с критическими параметрами (pк, Vк, Tк) называется критическим состоянием. При низких температурах (Т < Tк ) изотермы имеют волнообразный участок, сначала монотонно опускаясь вниз, затем монотонно поднимаясь вверх и снова монотонно опускаясь.
Для
пояснения характера изотерм преобразуем
уравнение Ван-дер-Ваальса (61.2) к виду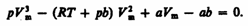
Внутренняя энергия реального газа складывается из кинетической энергии теплового движения его молекул и из потенциальной энергии межмолекулярного взаимодействия. Потенциальная энергия реального газа обусловлена только силами притяжения между молекулами. Наличие сил притяжения приводит к возникновению внутреннего давления на газ. р΄=а/V2
