
- •Тема: механика
- •Кинематика поступательного движения. Скорость и ускорение материальной точки. Составляющие ускорения. Кинематическое уравнение
- •2)Динамика поступательного движения. Сила и масса. Три закона Ньютона
- •Силы в механике: силы тяготения (всемирного тяготения, тяжести, вес тела), сила упругости, сила трения.
- •5)Работа, мощность. Механическая энергия: кинетическая и потенциальная. Закон сохранения энергии.
- •Тема 2. Молекулярная физика и термодинамика
- •Идеальный газ. Уравнение состояния. Законы идеального газа.
- •Средняя кинетическая энергия молекулы идеального газа. Число степеней свободы. Температура.
- •4)Теплоемкость. И . Внутренняя энергия идеального газа. Работа газа.
- •5)Первое начало термодинамики. Применение его к изопроцессам.
- •6)Круговые процессы (циклы). Тепловые и холодильные машины. Кпд. Цикл Карно и его кпд.
- •7) Реальный газ. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса. Внутренняя энергия реальных газов.
- •Тема 3. Электростатика и постоянный электрический ток.
- •Электрический заряд. Закон сохранения электрического заряда. Закон Кулона.
- •Электростатическое поле. Напряженность (для точечного заряда, заряженной плоскости, поля конденсатора). Силовые линии и ее свойства. Принцип суперпозиции.
- •3)Потенциал. Эквипотенциальная поверхность. Связь напряженности и потенциала
- •Электрический ток. Сила тока и плотность тока. Сопротивление проводников и их соединения.
- •1. Соединение проводников
- •Напряжение. Электродвижущая сила. Сторонние силы.
- •Закон Ома для участка цепи и полной цепи. Правила Кирхгофа.
Тема 2. Молекулярная физика и термодинамика
Идеальный газ. Уравнение состояния. Законы идеального газа.
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией.
Собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда.
Между молекулами газа отсутствуют силы взаимодействия.
Столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Не учитываются размеры молекул.
Для
идеального газа справедливо уравнение
состояния идеального газа (уравнение
Менделеева-Клапейрона), показывающее
связь параметров P,
V,
T.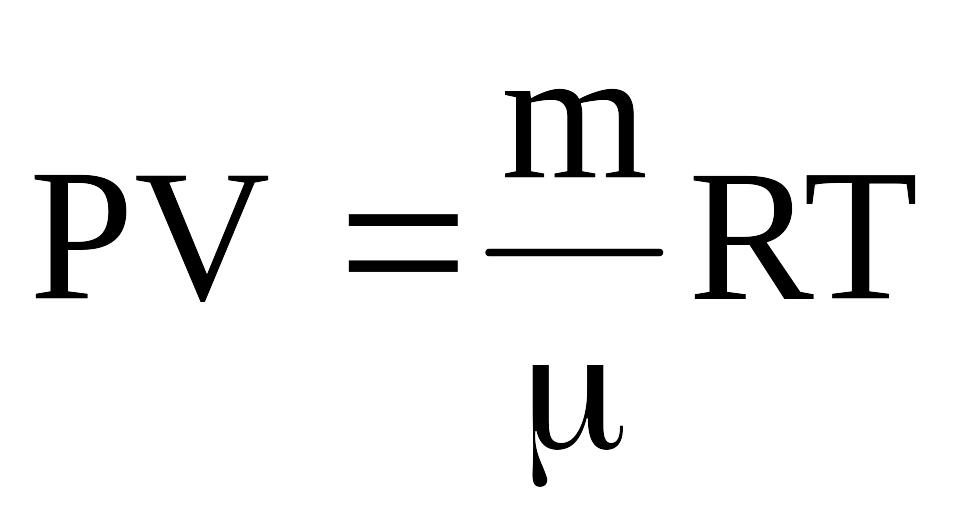 где
m
– масса газа; Р – давление газа; V
– объем газа; Т – температура газа; R
– универсальная газовая постоянная;
где
m
– масса газа; Р – давление газа; V
– объем газа; Т – температура газа; R
– универсальная газовая постоянная;
![]() - молярная масса газа.
- молярная масса газа.
Средняя кинетическая энергия молекулы идеального газа. Число степеней свободы. Температура.
Средняя
кинетическая энергия молекулы
идеального газа |
Величину T называют абсолютной температурой и измеряют в градусах Кельвина (К). Она служит мерой кинетической энергии теплового движения частиц идеального газа.
Если
выразить молярные теплоемкости Ср
и Сv
через число степеней свободы i
(число независимых координат с помощью
которых задается положение системы)
можно теоретически оценить величину
показателя адиабаты, зная, что
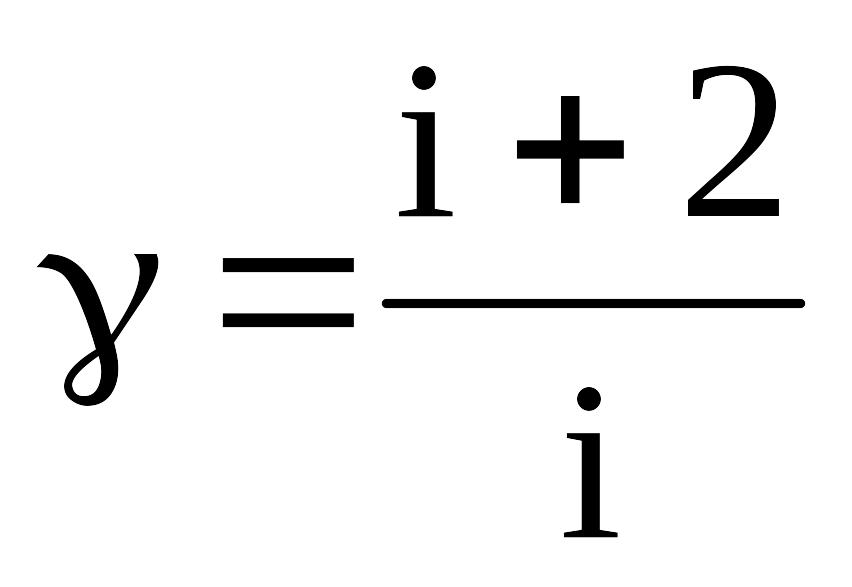
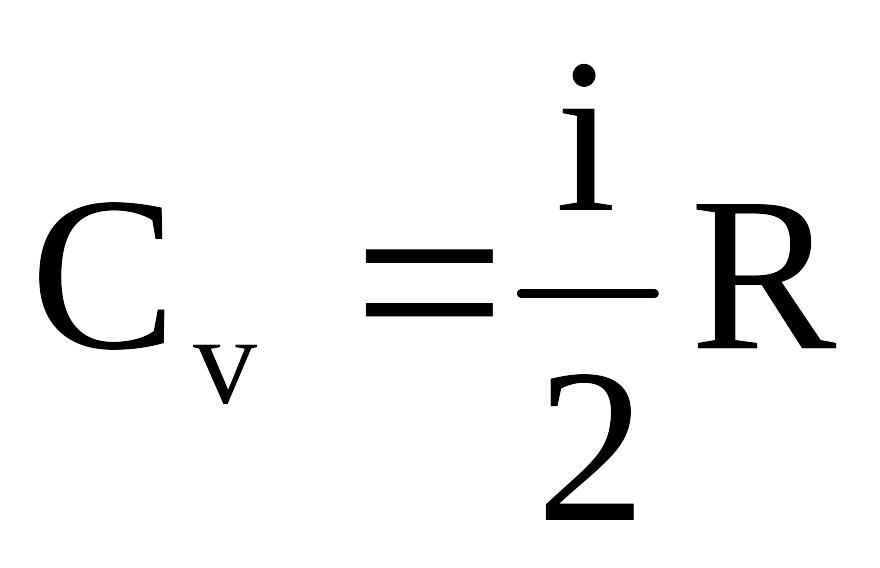 ;
;
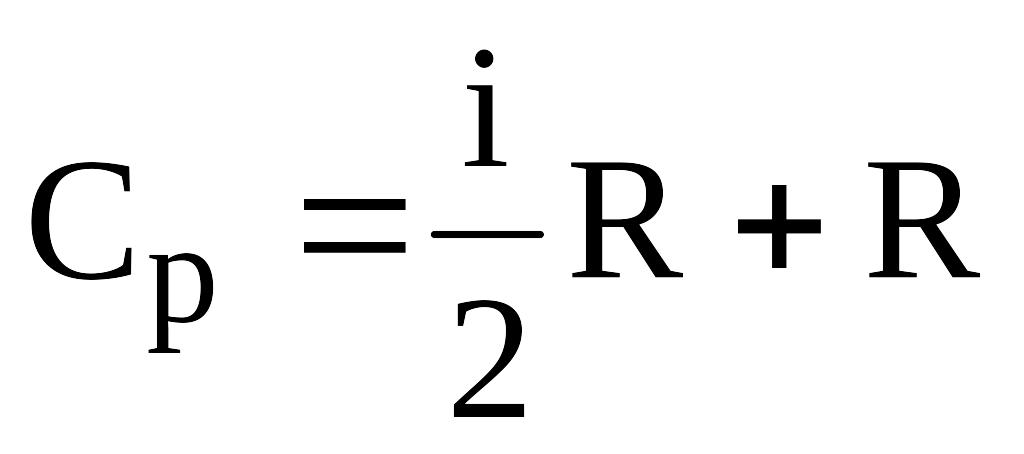 где
R
– универсальная газовая постоянная
где
R
– универсальная газовая постоянная
Число степеней свободы: наименьшее число независимых координат, определяющих положение и конфигурацию молекулы в пространстве.
Число степеней свободы для одноатомной молекулы -3 (поступательное движение в направлении трех координатных осей),для двухатомной - 5 ( три поступательных и две вращательных, т.к. вращение вокруг оси Х возможно только при очень высоких температурах), для трехатомной -6 ( три поступательных и три вращательных).
Температу́ра—
скалярная физическая величина,
характеризующая приходящуюся на одну
степень свободы среднюю кинетическую
энергию частиц макроскопической системы,
находящейся в состоянии термодинамического
равновесия.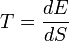 ,
,
где S — энтропия, E — энергия термодинамической системы.
3)Изопроцессы: изобарный, изохорный, изотермический, адиабатный
Изотермический
при Т=const;
PV=const.
Изобарический (изобарный) при P=const;
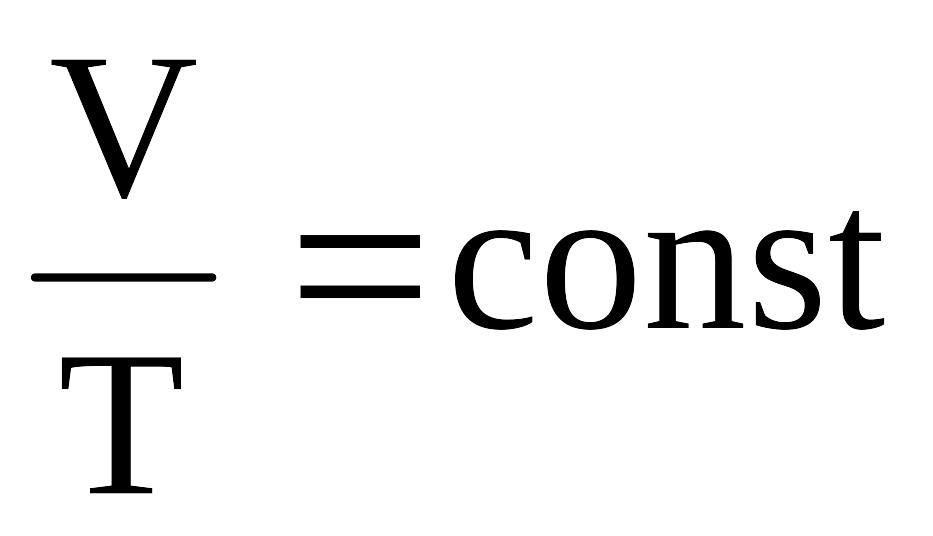 .Изохорический
(изохорный) при V=const;
.Изохорический
(изохорный) при V=const;
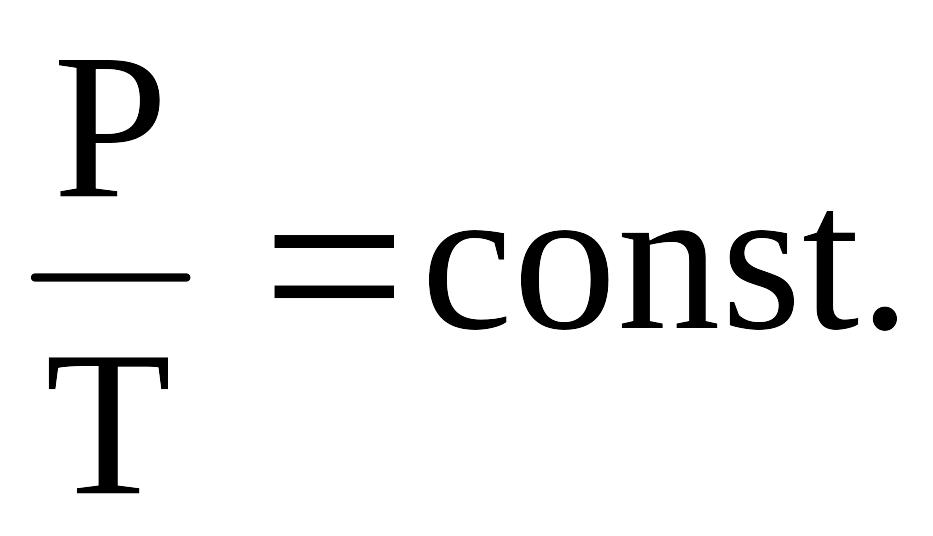 Адиабатический
(адиабатный) при S=const,
PVγ=const,
где S=энтропия;
γ-показатель адиабаты.
Адиабатический
(адиабатный) при S=const,
PVγ=const,
где S=энтропия;
γ-показатель адиабаты.
4)Теплоемкость. И . Внутренняя энергия идеального газа. Работа газа.
Молярные
теплоемкости Ср
и Сv
определяются из первого закона
термодинамики:
![]() т.е.
подводимая к системе теплота dQ
расходуется на приращение внутренней
энергии
т.е.
подводимая к системе теплота dQ
расходуется на приращение внутренней
энергии
![]() и на совершение работы dA
против внешних сил.
и на совершение работы dA
против внешних сил.
Теплоёмкость
тела (обычно обозначается латинской
буквой C) — физическая величина,
определяющая отношение бесконечно
малого количества теплоты δQ, полученного
телом, к соответствующему приращению
его температуры δT: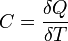
В
идеальном газе потенциальная энергия
взаимодействия молекул пренебрежимо
мала и внутренняя энергия равна сумме
энергий отдельных молекул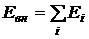 , где
Ei
— энергия
отдельной молекулы.
, где
Ei
— энергия
отдельной молекулы.
Внутренняя
энергия идеального газа определяется
кинетической энергией движения всех
его молекул. Средняя энергия движения
одной молекулы равна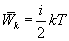
Работа
над газом выполняется внешними силами
при его сжатии. Работа самого газа
выполняется при его расширении.
![]() Заметим, что работа положительна, если
она выполняется газом, и отрицательна,
если внешние силы выполняют ее над
газом.
Заметим, что работа положительна, если
она выполняется газом, и отрицательна,
если внешние силы выполняют ее над
газом.

