
- •Тема 7 Мышечная ткань
- •Общая характеристика и классификация
- •Классификация мышечных тканей:
- •Поперечно-полосатая скелетная мышечная ткань
- •Миогенез
- •Регенерация
- •Сокращение и расслабление
- •Сердечная мышечная ткань
- •Сократительные
- •Сократительно-секреторные
- •Атипичные кардиомиоциты
- •Гладкая мускулатура
- •Регенерация
- •Немышечные сокращающиеся клетки
Сердечная мышечная ткань
Основа – упорядоченные интегрированные кардиомиоциты, которые образуют между собой многочисленные анастомозы. Волокна образуются не слиянием клеток, а путем объединения их при помощи вставочных дисков. Клеточные контакты – щелевые (нексусы), десмосомы. В промежутках рыхлая волокнистая неоформленная соединительная ткань с кровеносными и лимфатическими сосудами, нервами.
Выделяют 3 типа кардиомиоцитов:
сократительные;
сократительно-секреторные;
проводящие.
Сократительные
Высокодифференцированные. Длина 50-100 мкм, диаметр – 10-20 мкм, цилиндрические, могут ветвиться.
Сарколемма – цитолемма + базальная мембрана (10-40 нм), вместе с цитолеммой участвует в образовании канальцев Т-системы.
Ядро одно, реже два, овальные, ориентированы вдоль клетки. Преобладает эухроматин. Большинство ядер полиплоидно. Ядрышек 1-3. Ядерная оболочка образует многочисленные инвагинации. Вокруг ядер зона саркоплазмы, содержащая митохондрии, диктиосомы, рибосомы, центриоли, ГЭС.
Миофибриллы занимают большую часть саркоплазмы. Актиновые и миозиновые филаменты (6 : 1), Н-зона, I-диск, А-диск, L-трубочки, Z-полоска, М-полоска.
Митохондрии расположены цепочками вдоль миофибрилл, около ядра, под сарколеммой. Занимают около 35% объема.
Промежуточные филаменты – продольные и поперечные, проходят через М- и Z- полоски, скрепляют их, включаются в состав десмосом.
Концы кардиомиоцитов соединяются друг с другом, образуются цепочки – функциональные волокна - 10-20 мкм толщиной, которые формируют сеть. В области контакта двух кардиомиоцитов – вставочные диски. В области вставочного диска выступающие части одного кардиомиоцита входят в углубления другого – интердигитации, клеточные контакты – десмосомы, нексусы, адгезивные, расстояние между мембранами 20-30 нм. Нексусы обеспечивают обмен веществами между клетками и передачу возбуждения.
Расположение миофибрилл соседних кардиомиоцитов топографически точно соответствует друг другу, вставочный диск обеспечивает прочную связь между клетками и функциональное единство миофибрилл.
Боковые поверхности кардиомиоцитов соединяются многочисленными нексусами.
Сократительно-секреторные
Расположены главным образом в предсердиях, более полиморфны, имеют меньшие размеры. Менее выражен сократительный аппарат и саркоплазматическая сеть, меньше митохондрий. Нет типичных Т-трубочек.
Развиты ГЭС и КГ – происходит синтез пептидных гормонов, которые регулируют артериальное давление и гомеостаз сердца.
Атипичные кардиомиоциты
Этот устаревший термин относится к миоцитам, формирующим проводящую систему сердца. Среди них различают водители ритма и проводящие миоциты.
Водители ритма
Пейсмейкерные клетки (Р-клетки), пейсмейкеры – совокупность специализированных кардиомиоцитов в виде тонких волокон, окружённых рыхлой соединительной тканью. По сравнению с рабочими кардиомиоцитами имеют меньшие размеры. Ядро крупное, центрально расположенное. Т-система отсутствует. Мало гликогена и небольшое количество миофибрилл, лежащих в основном по периферии клеток. Эти клетки имеют богатую васкуляризацию и двигательную вегетативную иннервацию. Так, в синусно-предсердном узле доля соединительнотканных элементов (включая кровеносные капилляры) в 1,5–3 раза, а нервных элементов (нейроны и двигательные нервные окончания) в 2,5–5 раз выше, чем в рабочем миокарде правого предсердия.
Импульсгенерирующие, способны к самопроизвольным сокращениям. Главное свойство – спонтанная деполяризация плазматической мембраны. Главный водитель ритма – клетки синусно-предсердного узла – генерирует ритм 60–90 импульсов в минуту. Нормально активность других водителей ритма подавлена.
Спонтанная генерация импульсов потенциально присуща не только водителям ритма, но и всем атипичным, а также рабочим кардиомиоцитам. Так, in vitro все кардиомиоциты способны к спонтанному сокращению. В проводящей системе сердца существует иерархия водителей ритма: чем ближе к рабочим миоцитам, тем реже спонтанный ритм.
Проводящие кардиомиоциты
Проводящие кардиомиоциты – специализированные клетки, выполняющие функцию проведения возбуждения от водителей ритма. Образуют длинные волокна.
Пучок Гиса. Кардиомиоциты пучка проводят возбуждение от водителей ритма к волокнам Пуркинье, содержат длинные миофибриллы, имеющие спиральный ход; мелкие митохондрии и небольшое количество гликогена. Проводящие кардиомиоциты пучка Гиса входят также в состав синусно-предсердного и предсердно-желудочкового узлов.
Волокна Пуркинье. Проводящие миоциты Пуркинье - самые крупные клетки миокарда. Расположены в 1-2 слоя или скоплениями. Ядро в центральной части, округлое или овальное. Миофибрилл меньше чем в сократительных, разнонаправленные. Многочисленные мелкие митохондрии. Центральная часть клеток неструктурированна, заполнена гранулами гликогена. Слабо развита СПС. Не имеют Т-трубочек и не образуют вставочных дисков. Они связаны при помощи десмосом и щелевых контактов. Последние занимают значительную площадь контактирующих клеток, что обеспечивает высокую скорость проведения импульса по волокнам Пуркинье.
Сокращение
Потенциал действия распространяется от клеток Пуркинье.
Кальций входит через мембрану в клетку.
В отличие от скелетной поперечно-полосатой мускулатуры, характерна взаимосвязь между внутриклеточным депо кальция и внеклеточной средой, которая является основным источником ионов кальция для возбуждения. Если кальций во внеклеточной жидкости отсутствует сокращение прекращается в течение 1 минуты (скелетная мускулатура может работать в таких условиях около 1 часа).
Изменение конформации тропомиозина, взаимодействие актина и миозина.
Регенерация
Отсутствует камбиальная система. Нет деления клеток.
После повреждения, инфаркта, повышенной длительной функциональной нагрузки наблюдается увеличение органелл, незаконченное деление ядер и следовательно их полиплоидизация – отсюда увеличение, гипертрофия кардиомиоцитов.
При ишемической болезни сердца, кардиомиопатиях, миокардитах наблюдаются патологические изменения кардиомиоцитов, включая их гибель, что приводит к развитию сердечной недостаточности (нарушению насосной функции сердца). Репаративная регенерация кардиомиоцитов невозможна, т.к. они находятся в фазе G0 клеточного цикла, а аналогичные скелетномышечным клеткам-сателлитам G1-миобласты в миокарде отсутствуют. По этой причине погибшие кардиомиоциты замещаются соединительной тканью. Замещение погибших кардиомиоцитов соединительной тканью приводит к снижению сократительной способности миокарда и развитию сердечной недостаточности.
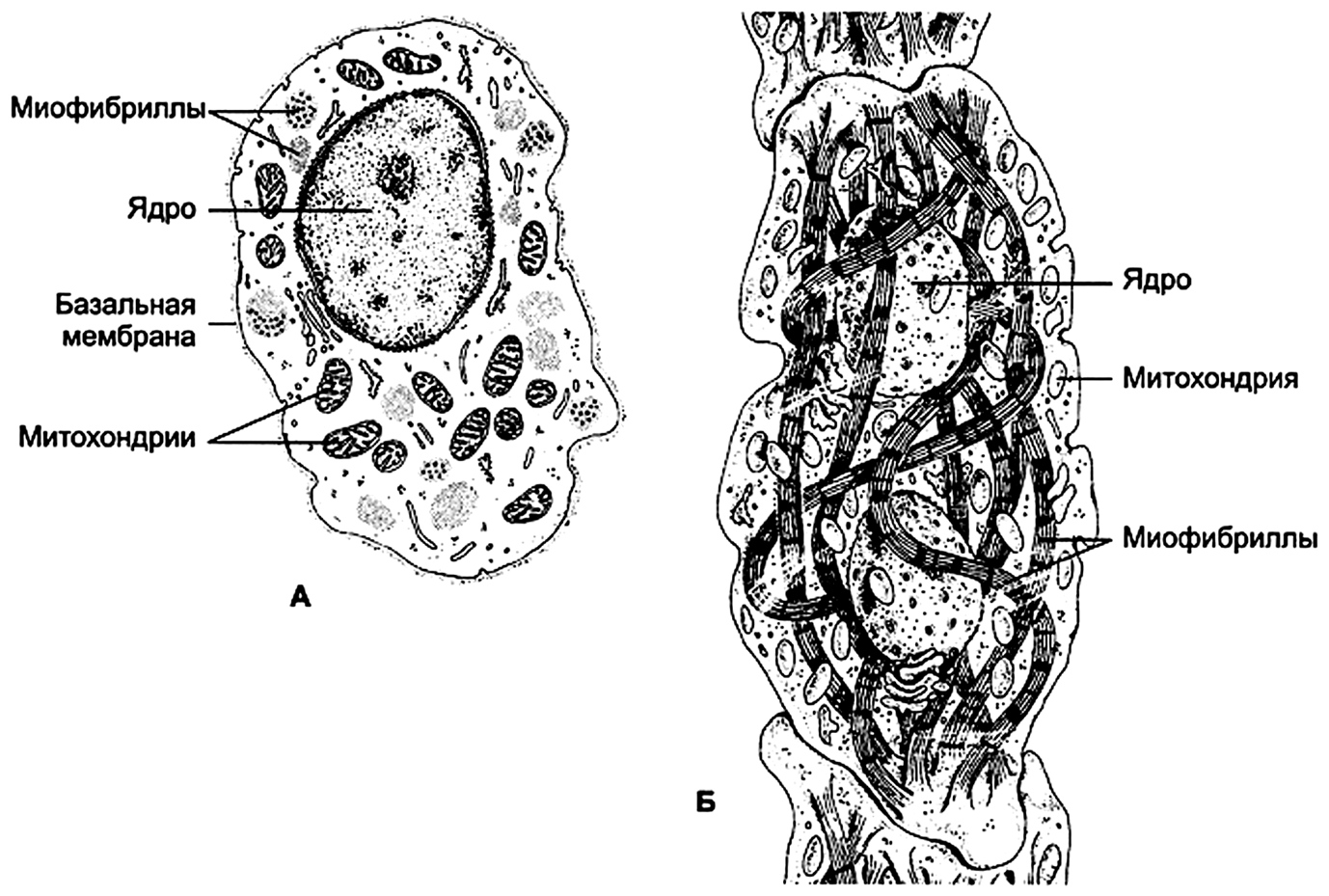
Атипичные кардиомиоциты А– водитель ритма синусно-предсердного узла, Б – проводящий кардиомиоцит пучка Гиса.
