
Санкт-Петербургский Институт
Точной Механики и Оптики (Технический университет).
Лабораторная работа №10
«Адсорбация органической кислоты на угле
из водного раствора»
Студент: Голицын С. Д.
Группа 110
ФОИСТ
Преподаватель: Табакова М. М.
Санкт - Петербург
-2002-
![]() Цель
работы:
Цель
работы:
Определить предельное значение удельной адсорбции и удельную поверхность твердого адсорбента.
![]() Краткая
теоретическая часть:
Краткая
теоретическая часть:
Адсорбция есть самопроизвольное изменение концентрации растворенного вещества у поверхности по сравнению с концентрацией его в объёме раствора. Различают положительную адсорбцию, когда концентрация растворенного вещества у поверхности больше его концентрации в объеме раствора, и отрицательную, когда концентрация растворенного вещества у поверхности меньше его концентрации в объеме раствора.
Положительно адсорбируются вещества менее полярные, чем растворитель, они называются положительно поверхностно-активными веществами (ППАВ). Растворенные вещества с большей полярностью, чем растворитель имеют большую концентрацию в объёме, т. е. они адсорбируются отрицательно и называются отрицательными поверхностно-активными веществами (ОПАВ). Удельная адсорбция есть количество вещества, приходящееся на единицу площади поверхности раздела фаз. Для расчета удельной адсорбции на жидкой поверхности раздела (газ/жидкость и жидкость/жидкость) пользуются уравнением изотермы адсорбции Гиббса:
Г = - (c / RT) * dσ / dc (1)
где Г - удельная адсорбция (моль/см2);
с – равновесная концентрация раствора (моль/л);
σ – поверхностное натяжение, т. е. работа образования единицы новой поверхности в изотермическом и обратимом процессе.
Уравнение Гиббса справедливо лишь в области разбавленных растворов.
Производная dσ / dc (изменение поверхностного натяжения с концентрацией) определяет характер адсорбции: если dσ / dc < 0, то Г > 0, т. е. адсорбируется ППАВ; если dσ / dc > 0, то Г < 0, т. е. адсорбируется ОПАВ.
На рис. 2а изображены изотермы поверхностного натяжения для ППАВ и ОПАВ; σ0 – поверхностное натяжение растворителя (например, воды).

Рис. 2а. Изотерма поверхностного Рис. 2б. Изотерма
натяжения адсорбции
Изотерма адсорбции изображена на рисунке 2б: удельная адсорбция сначала быстро, а затем замедленно растет с повышением концентрации и, наконец, достигает некоторого предельного значения Г∞, что связано с образованием предельно насыщенного адсорбционного слоя на поверхности. Дифильными молекулами называют молекулы, состоящие из полярной и неполярной частей (например, группы –ОН и углеводородной цепи в молекуле спирта) и проявляющие вследствие этого двойственный характер. В разреженном адсорбционном слое (рис3, а) адсорбированные дифильные молекулы располагаются вдоль поверхности, так как при этом достигается минимальное поверхностное натяжение раствора. Насыщенный адсорбционный слой иллюстрируется на рис. 3б.
Рис. 3б Строение адсорбционного слоя:
раствор
газ
жидкость
а)
б)

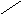



твёрдый
адсорбент
а – разреженный адсорбционный слой; б – насыщенный адсорбционный слой.
- обозначает полярную часть молекулы,
- неполярную.
Для вычисления удельной адсорбции газа (или растворенного вещества из раствора) на твердой поверхности можно воспользоваться эмпирическим уравнением изотермы адсорбции, предложенным Фрейндлихом:
x/m = k c1/n (2)
здесь х/m - масса или количество адсорбированного вещества (адсорбата), приходящегося на 1 г адсорбента (г/г или моль/г);
р – равновесное давление газа;
с – равновесная концентрация растворенного вещества (моль/л);
k и n – эмпирические константы, причем n > 1.
Уравнение Фрейндлиха описывает начальный криволинейный участок изотермы адсорбции (участок средних давлений).
Для нахождения констант эмпирического уравнения Фрейндлиха его подставляют в логарифмическом виде:
lg(x/m) = lg k + (1/n) lg c (3)
Построив график зависимости lg(x/m) = f (lg c), находят lg k как начальную ординату, а 1/n = tg - угловой коэффициент уравнения прямой линии (рис.4).
С помощью логарифмического графика можно определить пределы применимости эмпирического уравнения Фрейндлиха: точки лежат на одной прямой лишь в той области концентраций, где уравнение справедливо.
Теорию адсорбции газа на твердой поверхности предложил Ленгмюр, который считал, что адсорбционные силы действуют лишь на малых расстояниях (соизмеримых с размером молекулы) и приводят к образованию мономолекулярного адсорбционного слоя.
Рис.4. Логарифмический вид эмпирического уравнения
Изотермы адсорбции Фрейндлиха.
Lg
(x/m) Lg
(C) Lg
(K)
Ленгмюр, основываясь на положениях разработанной им теории, вывел уравнение изотермы адсорбции:
Г = Г kc / (1+ kc) (4)
Здесь Г – удельная адсорбция (моль/см2);
Г - предельная (максимальная) удельная адсорбция;
с – равновесная концентрация растворенного вещества (моль/л);
k – константа, зависящая от природы адсорбента и адсорбируемого вещества.
Уравнение Ленгмюра дает возможность определить предельную адсорбцию, чего не удается сделать с помощью уравнений Гиббса или Фрейндлиха. Адсорбция растворенного вещества из раствора на твердой поверхности является процессом более сложным, чем адсорбция газа, так как в этом случае имеет место взаимодействие трех компонентов: твердого адсорбента, растворителя и растворенного вещества. На твердой поверхности может происходить адсорбция как молекул растворенного вещества, так и растворителя; при прочих равных условиях активнее адсорбируется то из этих двух веществ, у которого больше энергия взаимодействия с твердым телом.
Различие в энергиях взаимодействия растворителей и адсорбента (твердой и жидкой фазы) проявляется в их способности смачивать поверхность твердого тела. В зависимости от способности твердого тела смачиваться жидкостями разной природы различают два типа твердых поверхностей: гидрофильные, избирательно смачивающиеся водой, и гидрофобные (или олеофильные), водой не смачивающиеся, но избирательно смачивающиеся неполярными жидкостями (маслами).
Гидрофильные поверхности имеют силикагель, глина, мел, стекло; гидрофобные – уголь, металлы, парафин и т.д. Отрицательная адсорбция растворенных веществ из водородных растворов, очевидно, будет происходить на гидрофобных адсорбентах, а из неводных – на гидрофильных. Дифильные молекулы адсорбирующихся веществ ориентируются своей полярной частью в полярную среду, а неполярной – в неполярную. При этом образовавшийся адсорбционный слой может изменить характер поверхности.
Рис.5. Адсорбция дифильных молекул
На неполярной твердой поверхности:
уголь
раствор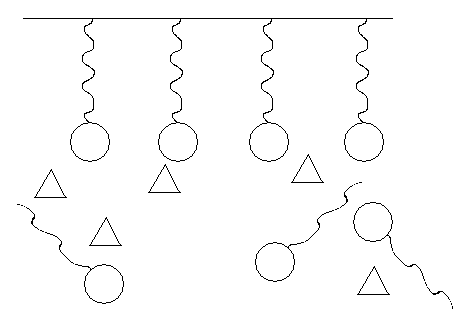


- дифильные молекулы; - молекулы воды.
При этом возможны гидрофобизация либо гидрофилизация поверхности адсорбента. Например, адсорбция дифильных молекул из водородного раствора на угле (рис.5) приводит к гидрофилизации поверхности угля, вследствие чего поверхность приобретает возможность смачивания водой. Возможно и обратное влияние. Подобный способ изменения характера поверхности с помощью адсорбционных слоев находит применение в технике: при разделении твердых частиц с различным поверхностным натяжением (флотация), при создании водоотталкивающих тканей и др.
Если известно предельное значение удельной адсорбции Г на поверхности раздела газ – жидкость, то можно определить величину удельной поверхности твердого адсорбента Sуд , то есть площади, приходящейся на 1 г адсорбента. Действительно, если адсорбированные молекулы образуют монослой с наиболее плотной упаковкой, то число молей, помещающихся на единице поверхности Г , определяется только эффективным поперечным сечением молекулы и не зависит от природы поверхности; поэтому для вычисления Sуд можно использовать величину Г
, найденную для границы раствор – воздух.
Так как x/m = Г Sуд , где Sуд – удельная поверхность адсорбента, а для предельной адсорбции x/m = Г Sуд , то:
Sуд = x/m Г [см2/г] (5)
Этот метод дает правильную ориентировочную оценку величины удельной поверхности адсорбента.
Поверхность твердого адсорбента сильно развита и площадь ее как правило неизвестна. Поэтому адсорбцию на твердой поверхности обычно относят не к единице поверхности, а к единице массы адсорбента, последний часто представляет собой порошок. Количество вещества адсорбированного из раствора на поверхности находят по разности концентраций его в растворе до, и после адсорбции:
x/m = (с0 - с) Vк/m (6)
где x/m – удельная адсорбция, моль/г или г/г;
с0 – концентрация раствора до адсорбции (моль/л);
с – равновесная концентрация после адсорбции (моль/л);
Vл – объем раствора кислоты, из которого происходит адсорбция, мл;
m – навеска (масса) твердого адсорбента, г.
Определение концентрации раствора до и после адсорбции может быть выполнено любым методом количественного анализа.
