
- •Заполнение электронами орбиталей:
- •Гибридизация ао – это взаимодействие (смешение) разных по типу, но близких по энергии атомных орбиталей данного атома с образованием гибридных орбиталей одинаковой формы и энергии.
- •Полярность связи
- •Э нтропия хим. Реакций. Энергия Гиббса
- •Химическое равновесие. Обратимые, необратимые реакции. Константа равновесия. Принцип Ле-Шателье
- •Катализ, его виды. Катализаторы, ингибиторы химических реакций.
- •Химические реакции делятся на реакции разложения, соединения, замещения, обмена, а также для органических веществ выделяют реакции изомеризации и поликонденсации.
- •Способы выражения состава растворов.
- •Гетерогенное равновесие. Растворимость и произведение растворимости.
- •Соль, образованная сильным основанием и сильной кислотой;
- •2)Соль, образованная слабым основанием и сильной кислотой;
- •Степень гидролиза h – отношение числа молей соли, подвергшихся гидролизу, к исходному количеству молей растворенной соли.
- •Классификация окислителей и восстановителей.Изменение о-в св-в в пс.
Химия- одна из естественных технических наук, наука а строении и свойствах веществ, и о превращениях их друг в друга. Химия, физика, биология только на первый взгляд могут показаться далекими друг от друга науками. Хотя лаборатории физика, химика и биолога очень непохожи, все эти исследователи имеют дело с природными (естественными) объектами. Это отличает естественные науки от математики, истории, экономики и многих других наук, изучающих то, что создано не природой, а прежде всего самим человеком.
П ростые
вещества — это вещества, образованные
из атомов одного элемента. Сложные
вещества, или химические соединения,
-- это вещества, образованные атомами
разных элементов.
ростые
вещества — это вещества, образованные
из атомов одного элемента. Сложные
вещества, или химические соединения,
-- это вещества, образованные атомами
разных элементов.
«атом»- химически неделимая электро-нейтралная мельчайшая частица вещества.
«молекула»- электрически нейтральная частица, состоящая из двух или более связанных ковалентными связями атомов, наименьшая частица химического вещества. (комбинация атомов).
«химический элемент»- совокупность атомов с одинаковым зарядом ядра и числом протонов, совпадающим с порядковым номером в таблице Менделеева. Каждый химический элемент имеет свои название и символ, которые приводятся в Периодической системе элементов Дмитрия Ивановича Менделеева. (вид атомов).
С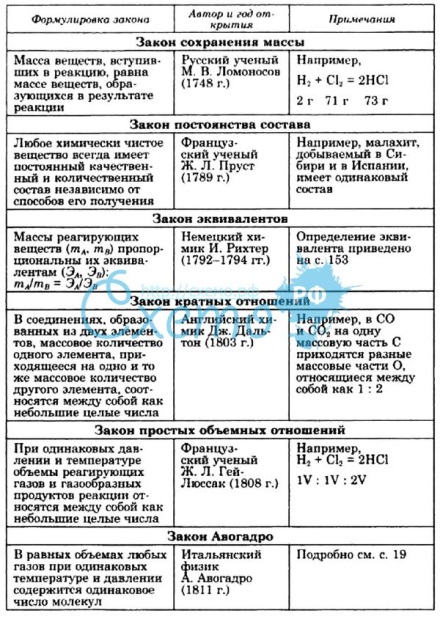 техиометрия
– раздел химии, в котором рассматриваются
массовые или объемные отношения между
реагирующими веществами. В химии
используются следующие стехиометрические
законы:
техиометрия
– раздел химии, в котором рассматриваются
массовые или объемные отношения между
реагирующими веществами. В химии
используются следующие стехиометрические
законы:
Атомы состоят из еще более мелких частиц, чем они сами, называемых электронами. Электроны вращаются вокруг центрального ядра, состоящего из одного или более протонов и нейтронов, по концентрическим орбитам. Электроны являются отрицательно заряженными частицами, протоны — положительными, а нейтроны — нейтральными. Каждая орбита называется оболочкой. Эти оболочки последовательно от ядра заполняются электронами.
Планетарная модель по Бору: 1) электроны вращаются вокруг ядра по некоторым орбитам, причем энергия электрона не меняется, 2) ближайшая к ядру электронная орбиталь соответствует устойчивому состоянию атома, 3) поглощая энергию, электрон переходит на удаленную орбиту (энергетический уровень), переходя в возбужденное состояние, 4) энергия электрона на орбите описывается:
E=-(2П2mee4)/(h2n2), где м и е- электрон, n-главное квантовое число, h-постоянная Планка.
Квантовая механика это система понятий, предназначенная для описания свойств микромира. Энергия распространяется, поглощается порциями, величина которых зависит от частоты излучаемого света: E=h*ню. Энергия тела меняется на величину, кратную h*ню, а электр заряд меняется на величину, кратную заряду электрона. Принцип неопределенности Гейзенберга: Невозможно одновременно точно определить положение микрочастицы и ее количество движения
Δx·Δ(m·v) ≥ h/2π = 1.05 10–34 Дж·с
Квантовая механика определяет вероятность нахождения микрочастицы в точке пространства.
Уравнение Шредингера (описание движения электрона):
(h2/8π2m)∇2Ψ + (E–U)Ψ = 0
E – полная энергия частицы с координатами x,y,z
U – потенциальная энергия частицы (x,y,z)
Ψ – волновая функция: описывает волны вероятности
∇ – действующий на функцию оператор.
Волновая функция, являющаяся решением уравнения Шредингера, называется орбиталью – областью пространства, вероятность нахождения электрона в которой ≥ 95%. Для описания орбитали требуются 3 квантовых числа:
Главное квантовое число n- указывает на энергетический уровень Э., общий запас энергии, расстояние от ядра. (только целые значения).
Орбитальное квантовое число l- характеризует форму электр. облака (форма орбитали) и значения от 0 до n-1. (l=0 (s), l=1 (p), l=2 (d), l=3 (f), l=4 (k) орбитали).
Магнитное квантовое число m- характеризует ориентацию плоскости орбиты и значения +-l.
Спиновое квантовое число s- характеризует собственное вращение электрона вокруг воображаемой оси (+- ½).
Заполнение электронами орбиталей:
- принцип наименьшей энергии, устойчивое состояние электрона в атоме соответствует мин возможному значению энергии,
- другое любое его состояние- возбужденное- из него э сам переходит в состояние с низкой энергией.
- принцип Паули- у любых 2 Э. в одном атоме набор 4 КЧ не может быть одинаковым. Каждая атомная орбиталь, характеризуется КЧ, может быть занята не более чем двумя Э,, спины имеющие противоположные знаки.
- правило Гунда- устойчивому состоянию атома соответствует распределение . в пределах энергетического подуровня, при котором значение суммарного спина мах.
- правило Клечковского- меньшей энергии соответствует мин значение суммы n+l, причем при том же значении суммы меньшей энергией обладает орбиталь с меньшим значением числа n.
Период закон- свойства простых тел, а так же формы и свойства соединений, находятся в периодической зависимости от величины атомных весов элементов, заряда ядра их атомов. Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Положительный заряд ядра атома равен порядковому номеру элемента в периодической системе менделеева. Заряд ядра= число протонов в ядре= число электронов в атоме= порядковый номер. Массовое число атома (А)= число протонов (Z) + число нейтронов (N). Атомы одного элемента, имеющие разные массовые числа, - изотопы. Свойства элементов и их соединений находятся в периодической зависимости от заряда ядра атома, или порядкового номера элемента.
Радиусы атомов элементов находятся в периодической зависимости от их порядкового номера. В периодах по мере увеличения заряда ядра радиусы атомов, в общем, уменьшаются, что связано с усилением притяжения внешних электронов к ядру. Наибольшее уменьшение атомных радиусов наблюдается у элементов малых периодов. В группах элементов радиусы атомов, в общем, увеличиваются, так как растет число электронных слоев. Таким образом, в изменении атомных радиусов элементов просматриваются разные виды периодичности: вертикальная, горизонтальная и диагональная. Важнейшие свойства элементов- металличность и неметалличность. Металличноть_ способность атомов элемента отдавать электроны, количественная характеристика- энергия ионизации: количество энергии, необходимое для отрыва электрона от атома элемента, т е для превращения атома в положительно заряженный ион. . В периодах по мере увеличения заряда ядра ЭИ увеличивается, в группах по мере увеличения ЭИ уменьшается. Неметалличность- способность атомов элемента присоединять электроны, количественная характеристика- сродство к электрону: энергия, выделяющаяся при присоединении электрона к нейтральному атому, т е при превращении атома в отрицательно заряженный ион. В периодах слева направо увеличивается с увеличением порядкового номера, а в группах с увеличением уменьшается. Универсальная характеристика м и н/м- электроотрицательность: характеризует способность его атомов притягивать к себе электроны, участвующие в образовании хим связей с другими атомами в молекуле. В периодах слева направо увеличивается с увеличением порядкового номера, а в группах с увеличением уменьшается.
М
 еталлы-
это группа веществ с общими свойствами.
Металлами являются элементы I-III
групп главных подгрупп, IV-VIII
групп побочных подгрупп. Из 109 элементов
85- металлы.( выделены голубым, зеленым,
розовым). Металлы- элементы, имеющие
на внешнем энергетическом уровне 1-3
электрона. Металлы- это хим элементы
атомы которых отдают электроны внешнего
электронного слоя превращаясь в
положительные ионы.
еталлы-
это группа веществ с общими свойствами.
Металлами являются элементы I-III
групп главных подгрупп, IV-VIII
групп побочных подгрупп. Из 109 элементов
85- металлы.( выделены голубым, зеленым,
розовым). Металлы- элементы, имеющие
на внешнем энергетическом уровне 1-3
электрона. Металлы- это хим элементы
атомы которых отдают электроны внешнего
электронного слоя превращаясь в
положительные ионы.

Н еметаллы
в системе расположены справа от диагонали
бор-астат..
Это элементы главных подгрупп III
IV
V
VI
VII
VIII
групп. Среди неметаллов два элемента-
водород и гелий- относятся к с семейству,
все остальные к п семейству. В отличие
от элементов-металлов изолированные
(нейтральные) атомы элементов-неметаллов
имеют большое число электронов на
внешних электронных оболочках.
Элементы-неметаллы имеют на последнем
слое от 4 до 8 электронов (бор – 3 электрона).
В периодической системе элементы-неметаллы
расположены в правом верхнем углу выше
диагонали алюминий-германий-сурьма-полоний.
В периоде с возрастанием заряда ядра
атома неметаллические свойства
усиливаются, т. к. увеличивается число
электронов на последнем слое. В подгруппе
с возрастанием заряда ядра неметаллические
свойства ослабевают, т. к. увеличивается
радиус атома и удерживать электроны
становится труднее. Наиболее активным
неметаллом является фтор.
еметаллы
в системе расположены справа от диагонали
бор-астат..
Это элементы главных подгрупп III
IV
V
VI
VII
VIII
групп. Среди неметаллов два элемента-
водород и гелий- относятся к с семейству,
все остальные к п семейству. В отличие
от элементов-металлов изолированные
(нейтральные) атомы элементов-неметаллов
имеют большое число электронов на
внешних электронных оболочках.
Элементы-неметаллы имеют на последнем
слое от 4 до 8 электронов (бор – 3 электрона).
В периодической системе элементы-неметаллы
расположены в правом верхнем углу выше
диагонали алюминий-германий-сурьма-полоний.
В периоде с возрастанием заряда ядра
атома неметаллические свойства
усиливаются, т. к. увеличивается число
электронов на последнем слое. В подгруппе
с возрастанием заряда ядра неметаллические
свойства ослабевают, т. к. увеличивается
радиус атома и удерживать электроны
становится труднее. Наиболее активным
неметаллом является фтор.
Химическая связь- сила, удерживающая вместе определенное количество атомов, ионов. Химическая связь возникает благодаря взаимодействию электромагнитных полей, создаваемых электронами и ядрами атомов. По своей природе эти силы являются электростатическими. Они представляют собой различные виды взаимодействия электрических зарядов. Существование этих структур обусловлено различными типами хим связи. Важнейшие их них: ковалентная, ионная, металлическая, водородная связи. Металлическая связь- существует в простых веществах металлах, Образуется в результате электростатического притяжения соседних ядер у делокализованным электронам, находящимся между ними. МС не направлена, осуществляется электронным газом. Ионная связь: существование молекул ионных соединений и ионных кристаллических решеток. Определяется электростатическим притяжением противоположно заряженных ионов, образовавшихся после перехода э. Она возникает между атомами с сильно различающимися ЭО. Не направлена в пространстве, не насыщаема. Водородная связь: существует внутри молекул отдельных веществ, а так же возникает между молекулами веществ. Соединение посредством атома водорода 2 других атомов высокой ЭО или одной и той же молекулы. Участвуют атомы высокой ЭО- O, F, N. Если атом водорода связывает одинаковые атомы высокой ЭО- ВС симметричная, если разной ЭО-асимметрична. Ковалентная связь: ХС, осуществляемая за счет образования общих э пар. При сближении атомов необходимо преодолеть отталкивание э оболочек, заряженных одноименно. Это возможно тогда, если спины э антипараллельны, так же происходит перекрывание облаков э. Способность атома образовывать определенное количество ХС- валентность. Если между 2 атомами образуется только одна общая э пара, то такая ковалентная связь- одинарная связь. Если КС образуется между атомами с одинаковой ЭО, то общая э пара находится на одинаковом расстоянии от ядер обоих атомов._ неполярная с. КС с неравномерным распределением э плотности между взаимодействующими атомами- полярная с. Если молекула из 2 атомов, у которых ПС, - полярная молекула- диполь: электронейтральная система, в которой центры положительного и отрицательного зарядов находятся на определенном расстоянии друг от друга. Расстояние межд центрами- длина диполя l. Количественной характеристикой полярности связей и молекул дипольный момент ( = произведение заряда на длину диполя).
Кислотно-основные свойства соединений элементов
Периодичность кислотно-основных свойств химических соединений наиболее наглядно прослеживается на примере оксидов и гидроксидов элементов в одинаковых степенях окисления, характерных для элементов одной группы (табл. 2). Общие формулы оксидов и гидроксидов элементов одной группы аналогичны.
Изменение форм и кислотно-основных свойств оксидов и
гидроксидов элементов в высших степенях окисления в периоде
Г Р У П П А |
||||||
I |
II |
III |
IV |
V |
VI |
VII |
Высшая положительная степень окисления элемента |
||||||
+1 |
+2 |
+3 |
+4 |
+5 |
+6 |
+7 |
Общая формула оксида |
||||||
Э2О |
ЭО |
Э2О3 |
ЭО2 |
Э2О5 |
ЭО3 |
Э2О7 |
Кислотно-основной характер оксида |
||||||
основной |
основной или амфотерный |
амфотерный |
кислотный или амфотерный |
кислотный |
кислотный |
кислотный |
Общая формула гидроксида |
||||||
ЭОН |
Н2ЭО2 Э(ОН)2 |
Э(ОН)3 ↨ Н3ЭО3 или НЭО2 |
Э(ОН)4 Н2ЭО3 или Н4ЭО4 |
НЭО3 или Н3ЭО4
|
Н2ЭО4 |
НЭО4 |
Кислотно-основной характер гидроксида |
||||||
Основание |
Основание или амфолит |
Амфолит |
Амфолит или кислота |
Кислота |
Кислота |
Кислота |
Примечание: Э – обозначение химического элемента;
амфолит, или амфотерный гидроксид.
Пример 9: Формулы кислот элементов VI группы подобны формуле серной кислоты H2SO4, хромовая кислота H2СrO4, теллуровая кислота H2TeO4 и т.д.
Оксиды и гидроксиды металлов могут быть основными, амфотерными (амфолитами) или кислотными в зависимости от степени окисления металла.
Теории кислот и оснований— совокупность фундаментальных физико-химических представлений, описывающих природу и свойства кислот иоснований. Все они вводят определения кислот и оснований -- двух классов веществ, реагирующих между собой. Задача теории -- предсказание продуктов реакции между кислотой и основанием и возможности её протекания, для чего используются количественные характеристики силы кислоты и основания. Различия между теориями лежат в определениями кислот и оснований, характеристики их силы и, как следствие -- в правилах предсказания продуктов реакции между ними. Все они имеют свою область применимости, каковые области частично пересекаются.
Кислотно-основные взаимодействия чрезвычайно распространенены в природе и находят широкое применение в научной и производственной практике. Теоретические представления о кислотах и основаниях имеют важное значение в формировании всех концептуальных систем химии и оказывают разностороннее влияние на развитие многих теоретических концепций во всех основных химических дисциплинах.
На основе современной теории кислот и оснований разработаны такие разделы химических наук, как химия водных и неводных растворов электролитов,рН-метрия в неводных средах, гомо- и гетерогенный кислотно-основный катализ, теория функций кислотности и многие другие.
Амфотерность -способность некоторых веществ в зависимости от условий проявлять либо кислотные, либо основные свойства; амфотерные вещества иногда называют амфолитами. Примерами могут служить гидроокиси алюминия, цинка, хрома и некоторых др. элементов. Так, Al(OH)3в водном растворе диссоциирует по двум направлениям:
![]()
![]()
В присутствии кислот преобладает первый тип диссоциации и соединение ведёт себя как основание, в присутствии более сильных оснований — как кислота:
![]()
![]()
Типичное амфотерное соединение — вода:
![]()
Степень амфотерности гидроокиси зависит от положения элемента в периодической системе элементов Д. И. Менделеева
Слева направо по периоду у элементов происходит ослабление металлических свойств, и усиление неметаллических свойств, основные свойства оксидов ослабевают, а кислотные свойства оксидов возрастают.
По главным подгруппам неметаллические свойства элементов ослабевают, а металлические усиливаются, поэтому: сверху вниз по главной подгруппе возрастают основанные свойства оксидов, а кислотные ослабевают.Если один и тот же элемент образует несколько оксидов с разными степенями окисления, то чем выше степень окисления элемента в оксиде, тем выше его кислотные свойства.
При образовании ковалентной связи в молекулах органических соединений общая электронная пара заселяет связывающие молекулярные орбитали, имеющие более низкую энергию. В зависимости от формы МО – σ-МО или π-МО – образующиеся связи относят к σ- или p-типу.
σ-Связь – ковалентная связь, образованная при перекрывании s-, p- и гибридных АО вдоль оси, соединяющей ядра связываемых атомов (т.е. при осевомперекрывании АО).
π-Связь – ковалентная связь, возникающая при боковом перекрывании негибридных р-АО. Такое перекрывание происходит вне прямой, соединяющей ядра атомов.
π-Связи возникают между атомами, уже соединенными σ-связью (при этом образуются двойные и тройные ковалентные связи). π-Связь слабее σ-связи из-за менее полного перекрывания р-АО.
Различное строение σ- и π-молекулярных орбиталей определяет характерные особенности σ- и π-связей.
σ-Связь прочнее π-связи. Это обусловлено более эффективным осевым перекрыванием АО при образовании σ-МО и нахождением σ-электронов между ядрами.
По σ-связям возможно внутримолекулярное вращение атомов, т.к. форма σ-МО допускает такое вращение без разрыва связи (аним., ~33 Kб). Вращение по двойной (σ + π) связи невозможно без разрыва π-связи!
Электроны на π-МО, находясь вне межъядерного пространства, обладают большей подвижностью по сравнению с σ-электронами. Поэтому поляризуемость π-связи значительно выше, чем σ-связи.
КРАТНОСТЬ СВЯЗИ- число электронных пар, обобществлённых двумя соседними атомами молекулы в результате ковалентной химической связи. Так, в молекуле этана Н 3 С-СН 3 связь С-С одинарная, К. с. равна единице (одна общая пара электронов); в молекуле этилена Н 2 С = СН 2 связь С = С двойная, К. с. равна двум (две - пары обобществлённых электронов);
К. с. не всегда выражается целым числом.
Характерные свойства ковалентной связи – направленность, насыщаемость, полярность, поляризуемость – определяют химические и физические свойства органических соединений.
Направленность связи обусловливает молекулярное строение органических веществ и геометрическую форму их молекул. Углы между двумя связями называют валентными.
Насыщаемость – способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они находятся от ядер.
Полярность и поляризуемость ковалентных связей определяют реакционную способность молекул по отношению к полярным реагентам.
