
- •Основы элементарной теории погрешностей
- •Расчет погрешностей прямых измерений
- •Определение погрешностей косвенных измерений
- •Зависимость силы тока в проводнике от приложенного к нему напряжения
- •Контрольные вопросы
- •Механика
- •Измерение линейных размеров и объема тела правильной геометрической формы
- •Постановка задачи
- •Порядок выполнения работы и обработка результатов измерений
- •Контрольные вопросы
- •Исследование прямолинейного поступательного движения в поле силы тяжести на машине атвуда
- •Постановка задачи
- •Порядок выполнения работы и обработка результатов измерений
- •Контрольные вопросы
- •Изучение вращательного движения твердого тела на маятнике обербека
- •Постановка задачи
- •Порядок выполнения работы и обработка результатов измерений
- •Контрольные вопросы
- •Изучение законов сохранения импульса и энергии при ударе
- •Постановка задачи
- •Порядок выполнения работы и обработка результатов измерений
- •Контрольные вопросы
- •7. Как экспериментально определяется коэффициент восстановления скорости, доля потерь механической энергии и средняя сила удара?
- •Определение коэффициента трения качения методом наклонного маятника
- •Постановка задачи
- •Порядок выполнения работы и обработка результатов измерений
- •Контрольные вопросы
- •Изучение сложного движения твердого тела на примере маятника максвелла
- •П 4 остановка задачи
- •Порядок выполнения работы и обработка результатов измерений
- •Контрольные вопросы
- •Определение скорости полета пули с помощью баллистического маятника
- •Постановка задачи
- •Порядок выполнения работы и обработка результатов измерений
- •Контрольные вопросы
- •Определение скорости полета пули с помощью баллистического крутильного маятника
- •Постановка задачи
- •Порядок выполнения работы и обработка результатов измерений
- •Контрольные вопросы
- •Свободные колебания пружинного маятника
- •Постановка задачи
- •Порядок выполнения работы и обработка результатов измерений
- •Контрольные вопросы
- •Изучение свободных затухающих колебаний физического маятника
- •Постановка задачи
- •Порядок выполнения работы и обработка результатов измерений
- •Контрольные вопросы
- •Определение ускорения свободного падения с помощью математического и физического маятников
- •Постановка задачи
- •Порядок выполнения работы и обработка результатов измерений
- •Контрольные вопросы
- •Колебания связанных маятников
- •Постановка задачи
- •Описание экспериментальной установки
- •Порядок выполнения работы и обработка результатов измерений
- •Контрольные вопросы
- •Определение модуля сдвига и модуля юнга проволоки методом крутильных колебаний
- •Постановка задачи
- •Порядок выполнения работы и обработка результатов измерений
- •Контрольные вопросы
- •Молекулярная физика
- •Определение молярной массы, плотности воздуха и концентрации молекул кислорода
- •Постановка задачи
- •Порядок выполнения работы и обработка результатов измерений
- •Контрольные вопросы
- •Определение коэффициента внутреннего трения жидкости методом падающего шарика (метод стокса)
- •Постановка задачи
- •Порядок выполнения работы и обработка результатов измерений
- •Контрольные вопросы
- •Определение коэффициента вязкости и средней длины свободного пробега молекул газа
- •Постановка задачи
- •Cхема экспериментальной установки
- •Порядок выполнения работы и обработки результатов измерений
- •Контрольные вопросы
- •Определение отношения для воздуха методом клемана-дезорма
- •Постановка задачи
- •Порядок выполнения работы и обработка результатов измерений
- •Контрольные вопросы
- •Определение скорости звука и показателя адиабаты для воздуха
- •Постановка задачи
- •Контрольные вопросы
- •Определение коэффициента поверхностного натяжения методом кантора-ребиндера
- •Постановка задачи
- •Порядок выполнения работы и обработка результатов измерений
- •Контрольные вопросы
- •Определение удельной теплоты кристаллизации и изменения энтропии при охлаждении олова
- •Постановка задачи
- •Порядок выполнения работы и обработка результатов измерений
- •Контрольные вопросы
- •Измерение коэффициента теплопроводности воздуха методом нагретой нити
- •Постановка задачи
- •Порядок выполнения работы и обработка результатов измерений
- •Контрольные вопросы
- •Получение и измерение вакуума
- •Постановка задачи
- •Создание и измерение вакуума
- •Порядок выполнения работы и обработка результатов измерений
- •Краны (4) и (10) должны быть закрыты. Следует помнить, что давление внутри баллона равно разности давления атмосферного и показания мановакуумметра.
- •Контрольные вопросы
- •Изучение распределения больцмана
- •Постановка задачи
- •Порядок выполнения работы и обработка результатов измерений
- •Контрольные вопросы
- •Изучение реальных газов
- •Постановка задачи
- •Уравнение состояния газа Ван - дер - Ваальса
- •Порядок выполнения работы и обработка результатов измерений
- •Контрольные вопросы
- •Образец отчета лабораторной работы
- •Отчет по лабораторной работе 1-1 измерение линейных величин и объемов тел правильной геометрической формы
- •Правила построения графиков
- •Список литературы Основная литература
- •Дополнительна литература
- •Содержание
- •625000, Тюмень, ул. Володарского, 38.
- •6 25039, Тюмень, ул. Киевская, 52.
Уравнение состояния газа Ван - дер - Ваальса
Голландский физик Ван - дер – Ваальс в 1873 году предложил учитывать взаимодействие между молекулами и их размеры в виде поправок, вносимых в уравнение (1).
Поправка на внутреннее давление.
Необходимость
такой поправки обусловлено тем, что
между
молекулами вещества одновременно
действуют силы притяжения и силы
отталкивания, так как молекулы
представляют
собой
сложные
пространственные
структуры,
содержащие
как
положительные,
так
и
отрицательные
заряды.
Эти силы в
теории идеального газа во внимание не
принимаются.
Силы взаимодействия между молекулами
и атомами газа, не приводящие к образованию
химических соединений, называют
короткодействующими силами, так как
они проявляются на расстояниях
 10-9
м, сравнимых с размерами молекул.
10-9
м, сравнимых с размерами молекул.
Зависимости результирующей силы F и потенциальной энергии Ep взаимодействия между молекулами от расстояния между их центрами представлены на рис. 2. При некотором расстоянии r = r0 результирующая сила межмолекулярного взаимодействия обращается в нуль F=0. Это расстояние условно можно принять за диаметр молекулы d. Таким образом, расстояние r0 соответствует равновесному состоянию между молекулами, на котором они находились бы в отсутствии теплового движения. При r < r0 преобладают силы отталкивания (Fо > 0). При r > r0 преобладают силы притяжения Fп < 0. Доказательством преобладания сил притяжения над силами отталкивания является слияние капелек жидкости. На расстоянии >10-9 м межмолекулярные силы практически отсутствуют (рис. 2).

Рис. 2. Результирующая сила взаимодействия F и потенциальная энергия
взаимодействия Ep двух молекул. F > 0 –отталкивание, F < 0 –притяжение
Потенциальная энергия взаимодействия при r = r0 минимальна. Чтобы удалить друг от друга две молекулы, находящиеся на расстоянии r0, нужно сообщить им дополнительную энергию E0. Величина E0 называется глубиной потенциальной ямы или энергией связи молекулы.
Когда молекула газа летит к стенке сосуда, а затем отражается от нее, то изменяется ее импульс. Однако, в отличие от идеальных газов, импульс налетающих молекул изменяется не только под действием сил со стороны стенки, но и под действием сил, с которыми их тянут внутрь объема молекулы пристеночного слоя газа (в случае преобладания сил притяжения). В частности, под действием этих сил молекула может отразиться внутри пристеночного слоя, не долетев до стенки. Пусть Р давление стенки сосуда на газ (ее зафиксирует манометр), а Рi – средняя сила, отнесенная к единице площади, с которой молекулы пристеночного слоя втягиваются внутрь газа. Тогда давление, под которым находится газ, будет больше, чем покажет манометр и определится суммой Р + Рi.
Поправка на собственный объем молекул.
Так как молекулы газа имеют собственный объем, часть объема сосуда (а при высоких давлениях, она оказывается сопоставима с объемом сосуда) оказывается занятой ими. Свободный объем для молекул реального газа находят, вычитая из объема сосуда V «запрещенный» объем νb, обусловленный собственным объемом молекул (V–νb). Внесение Ван дер Вальсом поправок на внутреннее давление и собственный объем молекул в уравнение (1) привело к уравнению ,носящее его имя
(Р + Рi ) (V –νb)= νRT ( 2)
где Р - давление, измеряемое манометром, V-объем сосуда, νb «запрещенный» объем, b- постоянная для данного газа, Т–абсолютная температура, ν-число молей, R- универсальная газовая постоянная.
Для изотермического процесса ( Т – постоянна ) νRT = Const. Используя выражение (2) получим для двух различных состояний (Р0,V0; Р,V ) газа уравнение:
(Р0 + Рi0 ) (V0 –νb)= (Р + Рi ) (V –νb). (3)
При комнатных давлении, объеме и температуре (начальные условия Р0,V0) внутреннее давление Рi0 для газа, который будет изучаться, много меньше Рi0 ‹‹ Р0 , а объем сосуда V » νb , тогда введенными поправками можно пренебречь. В результате из выражения (3) получим формулу для оценки внутреннего давления в виде.
 (4)
(4)
Вычитаемое в формуле (4) можно получить из закона Бойля- Мариотта оно определяет собой давление Рид, т.е. давление идеального газа, давление, которое имел бы газ, если бы взаимодействие между молекулами и собственный объем молекул были пренебрежимо малы.
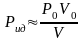 (5)
(5)
СХЕМА ЭКСПЕРИМЕНТАЛЬНОЙ УСТАНОВКИ
Изучаемый газ (бутан С4Н10) заключен в стеклянной трубке 1 (рис. 3.) Давление в установке создается винтом с поршнем 5, который сжимает эластичный баллон, наполненный жидкостью 3. Жидкость поступает в стеклянную трубку и подобно поршню сжимает парогазовую среду. Она состоит из исследуемого газа и насыщенного пара жидкостного поршня. Внутреннее давление в трубке P, измеряемое манометром, складывается из парциального давления изучаемого газа Pг и давления насыщенного пара Рп, определяемого температурой жидкости. Парциальное давление исследуемого газа будет равно
Р г = Р - Рп .. (6)

Рис. 3. Лабораторная установка по изучению реального газа:
1-прозрачная трубка с газом; 2 - жидкостный поршень; 3 - эластичный бал
лон, заполненный жидкостью;4- плунжер;5 - винт для сжатия;
6-манометр; 7-электронный термометр с термопарой;8- источник тока
нагревателя; 9- заглушка; 10 - конденсат
При комнатной температуре t = 24˚C Pп=0,03aт., при 50˚С Pn = 0,12 ат. Учитывая, что цена деления манометра 0,2ат поправку на Pп можно считать систематической ошибкой. Ей можно пренебречь, если не требуется высокая точность измерений.
Так как вся система газ-жидкость находится под атмосферным давлением Ратм, то давление Р, которое испытывает исследуемый газ определим, пренебрегая вкладом Pн, по формуле
Р = Ратм .+ Рм (7)
Объем газовой фазы в установке определяется по высоте h газового столба известного и постоянного сечения S. Так как S- площадь сечения трубки (равна 7.1 мм2), а h-высота столба газа, то объем газа равен V = hS. На этом основании формулу ( 6 ) представим в виде
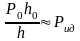 (8)
(8)
Нагревание газа осуществляется путем пропускания тока по тонкой металлической ленте, наклеенной с боков трубки. Температура трубки (газа) измеряется электронным термометром с термопарой, спай которой вплотную прилегает к трубке.
Приборы. Технический барометр, цена деления 0,2 ат. (Одна техническая атмосфера 1 ат = 0,98·105 Па ); миллиметровая линейка, цена деления 1 мм. Электронный термометр, цена деления 0,1 0 С.
